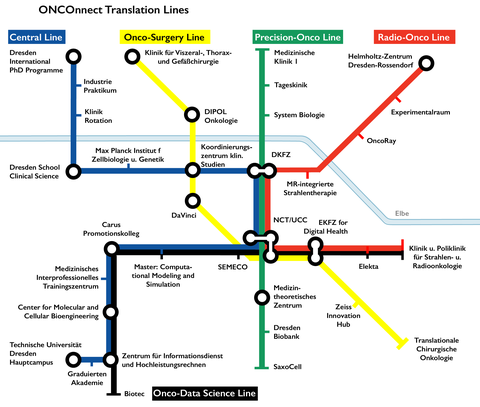
Translation Lines
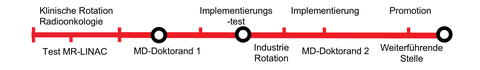
Meilensteine Radio-Onco Line
Entwicklung von Methoden zur Bewegungskompensation in der MR-integrierten Protonentherapie
Pipeline Leaders
- Prof. Dr. med. Dr. Esther Troost ist Professorin für Bildgestützte Hochpräzisions-Strahlentherapie und Forschungsgruppenleiterin am HZDR. Für ihre Forschungstätigkeiten im Bereich Bildgebung und Protonentherapie wurde sie mit dem ESTRO-VARIAN Award und dem DEGRO-ACCURAY-Hochpräzisions-Preis ausgezeichnet. Sie ist PI zahlreicher internationaler Forschungsprojekte und Gutachterin für diverse Förderorganisationen.
- Prof. Dr.-Ing. Aswin Hoffmann ist Professor für Experimentelle MR-integrierte Protonentherapie und Forschungsgruppenleiter am HZDR, wo er als ausgewiesener Experte (Roberts’ Prize, Donal Hollywood Award) im Bereich der MRT-Bildgebung unter anderem das Programm zur weltweit ersten Patienten-Behandlung mit MR-integrierter Protonentherapie leitet.
Projekt
In der technologischen Entwicklung bildgesteuerter Strahlentherapie hat in den letzten Jahren das Konzept der Integration der Echtzeit-Magnetresonanz-Bildsteuerung großes Interesse gefunden. Eine MRT-geführte Strahlentherapie mit Photonen oder zukünftig mit Protonen ermöglicht die Echtzeit-Positionsverfolgung von beweglichen Weichgewebstumoren und hat das Potential, die Behandlungsqualität vieler Krebspatienten zu verbessern. Das OncoRay ist weltweit führend bei der Integration von hybriden Systemen und arbeitet seit 2015 systematisch an der Etablierung der MRT-integrierten Protonentherapie (MRiPT). Seit Mai 2022 steht zudem ein MR-integrierter Linearbeschleuniger (MR-LINAC) für die Photonentherapie zur Verfügung, der über Gating- (Aktivierung des Strahls ausschließlich bei optimaler Tumorposition) und Tracking- (Anpassung der Bestrahlungsfelder an die Tumorposition) Verfahren verfügt. Um die Eigenschaften des MRiPT Geräts bestmöglich zur Anwendung bringen zu können, ist die technische Führung des Strahls zur Kompensation von Bewegung unabdingbar. Ziel der Promotionsarbeit des Medical Scientists (mögl. akademischer Hintergrund: Physik, Medizinische Physik, Bioengineering) wird es sein, diese Gating- und Tracking-Verfahren an der Protonen-Beamline zu etablieren. Einführend (Jahr 1) wird eine klinische Rotation am MR-LINAC absolviert, bevor mit dosimetrischen Messungen und Phantomstudien begonnen werden kann. Die Industrierotation (Jahr 3) wird bei der Firma Elekta durchgeführt, die den MR-LINAC entwickelt hat. Anschließend werden in silico Patienten-Simulationen folgen. Im Rahmen der Promotion wird der Medical Scientist einen wichtigen Beitrag zur Weiterentwicklung des MRiPT Prototyps leisten, der am OncoRay weltweit erstmalig Patienten mit beweglichen Tumoren behandeln soll. Auch die Erkenntnisse der MD Projekte am MR-LINAC werden unmittelbar in die Entwicklung des Gating-Ansatzes für die Protonentherapie fließen. Die Kooperationen zwischen Clinical und Medical Scientists sowie Betreuer sind durch den Erfahrungsaustausch und die fachübergreifende Vernetzung nicht additiv, sondern synergistisch.

Team Radio Onco
Editierung von Krebs-Mutationen in aus Patientenzellen generierten Organoiden (PDOs)
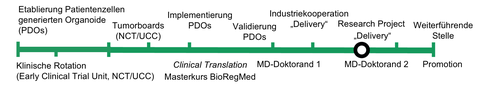
Meilensteine Precision-Onco Line
Pipeline Leaders
- Prof. Dr. rer. nat. Frank Buchholz ist Professor für Medizinische Systembiologie und international anerkannter Experte im Bereich der translationalen onkologischen Forschung am NCT/UCC. Er ist zudem ein ausgewiesener Experte im Bereich des Genome Editing. Seine Forschung wird u. a. von einem ERC Advanced Grant gefördert und schon mehrfach in klinische Studien und insgesamt vier Start-up Ausgründungen translatiert (z. B. GO-Bio Grant).
- Prof. Dr. med. Martin Bornhäuser ist Professor für Hämatologie und Medizinische Onkologie, Leiter der Medizinischen Klinik I am UKD und einer der geschäftsführenden Direktoren des NCT/UCC Dresden. Er ist ein ausgewiesener klinischer Experte der Präzisionsonkologie mit Schwerpunkt auf hämatologischer Neoplasien und hat als Co-Sprecher mit SaxoCell Exzellenzforschung im Bereich Zelltherapie in Sachsen etabliert.
Projekt
Der Medical Scientist (mögl. akademischer Hintergrund: Biologie, Molekulare Medizin, Bioengineering) wird eine Pipeline entwickeln, mit deren Hilfe identifizierte Mutationen in aus Patientenzellen generierten Organoiden (PDOs) unter Heranziehung etablierter Genome-Editing-Technologien inaktiviert oder repariert werden. Hierzu werden zunächst PDOs zusammen mit der Preclinical Model Unit des NCT/UCC ausgewählt, welche adressierbare Treiber Mutationen tragen. sgRNAs gegen diese Mutationen werden anschließend designt und in lentivirale Vektoren kloniert. Die Abhängigkeit der PDOs von diesen Mutationen wird daraufhin mit etablierten Assays untersucht. Die im Projekt gewonnenen Informationen hinsichtlich krebstreibender Mutationen werden an das molekulare Tumorboard weitergeleitet, um Klinikern bei der Ermittlung optimierter und individueller Behandlungsoptionen für Krebspatienten zu unterstützen. Neben der Etablierung als diagnostisches Werkzeug, soll die Technologie auch als mögliche Therapie weiterentwickelt werden. Hierzu werden verschiedene Lipid-Nanopartikel als mRNA Formulierungen von CRISPR Base-Editoren/sgRNAs in Kooperation mit der Firma BioNTech getestet. Ziel ist es, Formulierungen zu identifizieren, die effizientes Korrigieren von Driver Mutationen via mRNA Delivery ermöglichen. Positive Ergebnisse werden in Kooperation mit der Early Clinical Trial Unit für die Translation vorbereitet. Der Medical Scientist erhält durch die Medizindoktoranden effiziente Unterstützung an der Schnittstelle zwischen Klinik und Labor (Protokollerstellung, informed consent, Ethikvotum etc.). Die Medizindoktoranden erhalten Einblick in neue Entwicklungen in der Präzisionsonkologie und die Option, eine attraktive Arbeit mit etablierten Methoden durchzuführen.

Team Precision Onco
Optimierung des onkologischen Verlaufs durch perioperative Komplikationsvorhersage auf Basis von Biomarker mittels Surgical Data Science

Meilensteine Onco-Surgery Line
Pipeline Leaders
- Prof. Dr.-Ing. Stefanie Speidel ist als Professorin für translationale chirurgische Onkologie am NCT und ausgewiesene Expertin im Bereich Surgical Data Science und Künstliche Intelligenz (KI)-gestützter Chirurgie. Sie ist Co-Sprecherin des Exzellenzclusters CeTI sowie der KI School SECAI mit Fokus auf KI-Anwendungen in der Medizin sowie im Steering Board des EKFZ-DG. Sie ist PI in zahlreichen Konsortien, insbesondere koordiniert sie das BMG geförderte Projekt SurgOmics.
- Prof. Dr. med. Lena Seifert ist Oberärztin für spezielle Viszeralchirurgie und eine ausgewiesene Expertin im Bereich tumorimmunologischer Forschung in gastrointestinalen Tumoren. Sie führt routinemäßig viszeralonkologische Operationen durch, betreut Patienten mit benignen und malignen Pankreaserkrankungen und leitet die Pankreassprechstunde in der Klinik für Viszeral-, Thorax- und Gefäßchirurgie (VTG). Lena Seifert wurde mit dem Ernst-Jung-Karriere-Förderpreis ausgezeichnet und konnte 2021 eine Else Kröner Clinician Scientist Professur einwerben.
Projekt
Neue Methoden der Künstlichen Intelligenz zur perioperativen Komplikationsvorhersage haben das Potenzial, chirurgisch unerwünschte Ereignisse zu reduzieren und den weiteren onkologischen Verlauf zu optimieren (z. B. Verabreichung und Abschluss der adjuvanten Therapie). Dies gilt insbesondere für lokaltherapeutische Ansätze, die in Kombination mit Data Science Methoden und neuen technologischen Ansätzen wie OP-Robotern durchgeführt werden. Das NCT/UCC ist hierbei führend und einer der Initiatoren der Surgical Data Science Initiative. Der Medical Scientist (mögl. akademischer Hintergrund: Informatik, Data Science) wird im Bereich der prä- und intraoperativen Komplikationsvorhersage neue Methoden erforschen und eine zentrale Rolle in der Vernetzung grundlagenwissenschaftlicher und technologischer Ansätze mit der klinischen Anwendung in der VTG einnehmen. Auf Basis von heterogenen prä- und intraoperativen Patientendaten werden mittels neuen KI-Ansätzen, wie Transformers oder Convolutional Neural Networks, Komplikationsvorhersagen implementiert und Vorschläge zur Anpassung der Strategie realisiert. Es werden detaillierte tumorimmunologische und metabolische Analysen an präoperativen Biopsiematerial und Serumproben durchgeführt (Jahr 1 und 2) und mit dem postoperativen Verlauf korreliert. Ziel ist es, neue metabolische und immunologische Biomarker zur besseren Klassifizierung der perioperativen Morbidität und Mortalität (z. B. Risiko für Anastomoseninsuffizienz oder Pankreasfistel) zu identifizieren und als präoperative KI-basierte Methoden zu etablieren. Das Projekt ermöglicht es, Erkenntnisse zu neuen Biomarkern zur Optimierung des perioperativen Outcomes bei gastrointestinalen Tumoren bereits im dritten Promotionsjahr in der Klinik einzuführen. Durch die Anbindung von naturwissenschaftlichen PhD Studenten in den klinischen Alltag eines onkologischen Chirurgen und das Teaming mit einem medizinischen Tandempartner, wird die medizinisch-onkologische Kompetenz gefördert und es werden vielseitige Teamplayer in der interdisziplinären Translationsforschung generiert.

Team Onco Surgery
Multi-modales maschinelles Lernen zur Prognose von gastrointestinalen Tumoren
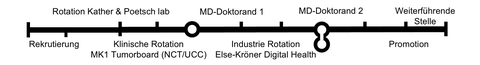
Meilensteine Onco-Data Science
Pipeline Leaders
- Dr. rer. nat. Anna Poetsch ist MSNZ Forschungsgruppenleiterin in Biomedizinischer Genomik am Biotechnologischen Zentrum der TU Dresden (TUD), dem NCT Dresden, und affiliiert mit dem Zentrum für Systembiologie Dresden. Sie ist eine ausgewiesene Expertin für die Analyse von Krebsgenomdaten mit speziellem Fokus auf Deep Learning von diesen Datentypen. Sie ist Mitglied von HEROES-AYA des BMBF-Dekade gegen Krebs und Mitglied des DFG Schwerpunktprogramms Genome3.
- Prof. Dr. med. Jakob Nikolas Kather ist Internist und Professor für Clinical Artificial Intelligence am EKFZ-DG. Für seine interdisziplinären Forschungsideen erhielt er zahlreiche Preise, u. a. den Heinz Maier-Leibnitz-Preis der DFG und des BMBF, der höchsten Auszeichnung für junge Wissenschaftler in Deutschland. In seiner interdisziplinären Arbeitsgruppe betreut Jakob Kather sowohl medizinische, als auch natur- und ingenieurwissenschaftliche Doktoranden.
Projekt
Onkologische Behandlungsalgorithmen werden zunehmend komplexer, während gleichzeitig die Menge der routinemäßig verfügbaren klinischen Daten, insbesondere auch der Daten in der individualisierten Krebstherapie, exponentiell zunimmt. Neue Instrumente und Fachkenntnisse ermöglichen es, multimodale klinische Daten mit Hilfe von informatisch-technischen Ansätzen für eine verbesserte klinische Entscheidungsfindung zu nutzen. Zu diesem Zweck werden retrospektiv vorliegende Datensätze zu gastrointestinalen Tumoren verwendet, da in diesen Tumoren sowohl histopathologische Bilder, als auch molekulare Marker in besonderer Weise zur Prognose beitragen und somit ein synergistischer Effekt bei der Kombination beider Datentypen zu erwarten ist. Der Medical Scientist der Onco-Data Science Line wird multimodale Datenanalysetools entwickeln, erweitern und klinisch validieren. Neben dem Erwerb der grundlegenden Fähigkeiten zur Analyse von histopathologischen Bildern mit Deep Learning, Daten zu somatischen Mutationen, Transkriptomen, sowie Labor und anderen tubulären Datentypen, wird das Projekt darauf fokussieren, diese Daten mit Hilfe von multimodalen Modellen zu prognostischen Zwecken und als Hilfe zur Behandlungsentscheidung zusammenzuführen. Hier werden insbesondere neueste Technologien des maschinellen Lernens, wie z. B. Transformer zum Einsatz kommen, die durch das direkt implementierte Aufmerksamkeitsmaß besonders für transparentes und interpretierbares Lernen geeignet sind. Diese Arbeiten werden in einem der Labore schwerpunktmäßig durchgeführt, wobei eine enge Anbindung an beide Gruppen sichergestellt wird. Der Medical Scientist (mögl. akademischer Hintergrund: Informatik, Data Science) wird in diesem Projekt die Translation von der Identifizierung einer klinisch relevanten Problemstellung über die Entwicklung neuer spezifischer KI-Methoden und schließlich die klinische Prüfung und die Entwicklung eines Medizinprodukts mitgestalten. In der Zusammenarbeit mit dem Medizindoktoranden ist die gemeinsame Kommunikation zentral, bei der beide Tandempartner die Fachsprache des jeweils anderen erlernen und anwenden müssen, um das Projekt gemeinsam erfolgreich abzuschließen.

Team Onco-Data Science