Projekte
1. Die Rolle von hämatopoetischen Stamm- und Vorläuferzellen bei nativer Blutbildung
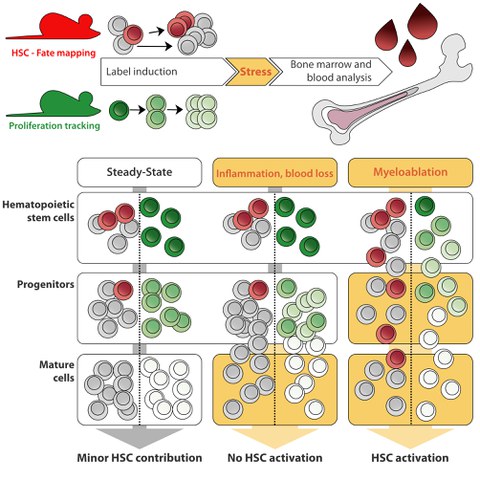
Ein erwachsener Mensch erneuert circa 1011 reife Blutzellen pro Tag, was Blut zum regenerativsten Gewebe überhaupt macht. Um die Proliferation und Differenzierung hämatopoetischer Stamm- und Vorläuferzellen in ihrer physiologischen Umgebung zu untersuchen, nutzen wir ausgefeilte Mausmodelle. So verwenden wir beispielsweise Cre/loxP-basierte Ansätze zur selektiven Markierung von HSCs in lebenden Tieren, um ihren Beitrag zur Regeneration von Blutzellen zu verfolgen. Um unsere experimentellen Daten zu analysieren und zu modellieren, arbeiten wir mit theoretischen Wissenschaftlern zusammen, was ein quantitatives Verständnis von nativer Hämatopoese ermöglicht. In Zusammenarbeit mit dem Labor von Thomas Höfer, DKFZ Heidelberg, konnten wir einen alternativen Weg der Bildung von Blutplättchen beschreiben, bei welchem sich HSC direkt in Megakaryozyten differenzieren, unter Umgehung von klassischen multipotenten Progenitoren (Morcos, Li, Munz et al., Nature Communications 2022). In Zusammenarbeit mit der Gruppe von Ingmar Glauche, IMB TU Dresden, konnten wir zeigen, dass HSC in adulten Mäusen überwiegend teilungsinaktiv sind, aber im Alter nicht einen dauerhaft ruhend Zustand eintreten (Morcos et al., Journal of Experimental Medicine 2020).
Man geht davon aus, dass es sich bei HSC um eine Reservepopulation handelt, die sich in einem teilungsinaktiven Zustand befindet, der sie vor metabolischem und proliferativem Stress schützt. Diesem Konzept zufolge werden die HSC durch einen erhöhten Bedarf an reifen Blutzellen in Situationen wie systemischen Infektionen oder schwerem Blutverlust aktiviert. Es hat sich gezeigt, dass eine häufige Exposition von HSC gegenüber solchen Stressfaktoren zu einer allmählichen Abnutzung ihres Transplantationspotenzials führt. Mit Hilfe unserer Fate mapping- und Proliferationsreporter-Modelle haben wir kürzlich untersucht, wie native Hämatopoese auf systemische Entzündungen oder Blutverluste reagiert (Munz et al., Blood 2023). Entgegen der landläufigen Meinung haben wir herausgefunden, dass diese Stressfaktoren die Differenzierung und Proliferation von HSC nicht nachhaltig stimulieren. Nur bei einer starken Störung der Blutbildung infolge sogenannter "myeloablativer" Konditionierung, wie z. B. hochdosierte ionisierende Strahlung oder Chemotherapie, sind HSC erforderlich um die Blutbildung neu zu starten.
In laufenden Forschungsprojekten untersuchen wir Blutbildung unter dem Einfluss von Mutationen, die entweder die Genauigkeit der Genomreplikation verringern (Dressel, Natusch et al.; bioRxiv 2022) oder die Entwicklung von Leukämien begünstigen. Darüber hinaus haben wir damit begonnen, Mausmodelle zu verwenden, bei denen vererbbare Markierungen in das Genom von einzelnen Zellen (sogenannte „genetische Barcodes“) eingeführt werden. Diese Technologie ermöglicht es uns, native Hämatopoese auf klonaler Ebene zu verfolgen.
Der seltene Beitrag von HSC zur adulten Hämatopoese im Gleichgewicht und unter Stress wirft die Frage nach der eigentlichen Funktion dieser Zellen auf. Die Relevanz von HSC für die adulte Blutbildung wurde zusätzlich in Frage gestellt durch unser Mausmodell für induzierbare HSC-Depletion, welches eine dauerhafte Reduzierung der HSC-Zahlen in vivo ermöglicht (Schoedel et al., Blood 2016). Wir konnten zeigen, dass die Hämatopoese in HSC-depletierten Mäusen trotz der sehr niedrigen HSC-Zahlen mehr als ein Jahr lang normal weiterlief und akuter hämatopoetischer Stress wurde von diesen Tieren gut vertragen. Mit Hilfe dieses Tiermodells untersuchen wir derzeit, wie das Zusammenspiel zwischen ruhenden Stammzellen und proliferierenden Vorläuferzellen sowie die hierarchische Organisation der Blutbildung, der Fixierung und Anhäufung somatischer Mutationen im hämatopoetischen System entgegenwirken kann.
2. Mastozytose und Herkunft von Mastzellen
Mastzellen sind gewebeständige Immunzellen hämatopoetischen Ursprungs und sind als Effektorzellen an allergischen Reaktionen und Anaphylaxie beteiligt. Zu den physiologischen Funktionen von Mastzellen gehört die Abwehr von Wurminfektionen und Insektengiften.
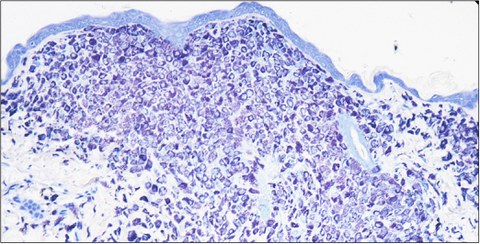
Mastozytose ist eine seltene menschliche Erkrankung, die durch pathologische Ansammlungen von Mastzellen in inneren Organen und der Haut gekennzeichnet ist. Bei der kindlichen Mastozytose beschränken sich die Mastzellinfiltrate in der Regel auf die Haut, und diese Variante der Erkrankung zeigt in der Regel eine spontane und vollständige Remission im Jugendalter. Erwachsene Patienten, die an systemischer Mastozytose leiden, weisen Mastzellinfiltrate im Knochenmark und in inneren Organen auf. Im Gegensatz zur pädiatrischen Variante zeigt die systemische Mastozytose bei erwachsenen Patienten keine Spontanremission. Trotz ihres heterogenen klinischen Erscheinungsbildes und Verlaufs weisen beide Krankheitsbilder dieselbe Gruppe von somatischen Mutationen in der Tyrosinkinase KIT (CD117) auf, die zu einer konstitutiven Aktivierung des Rezeptors und anhaltenden Wachstumssignalen führen.
Wir interessieren uns seit langem für Mastzellen (Scholten et al., Transgenic Research 2008 Weitzmann et al., Journal of Investigative Dermatology 2020) und die Erkrankung Mastozytose. Wir haben das KitD814Vflox-Mausmodell für Mastozytose entwickelt (Gerbaulet et al. Blood 2011), welches die konditionale Expression der KitD814V-Mutation ermöglicht, dem murinen Homolog von KITD816V, der häufigsten Mutation bei Mastozytosepatienten. Durch die Kombination des KitD814Vflox-Mausstammes mit verschiedenen zelltypspezifischen oder induzierbaren Cre-Allelen können wir verschiedene genetische Mosaike der somatischen Kit-Mutation modellieren. So können wir beispielsweise Tiermodelle erzeugen, welche die KitD814V-Mutation in allen Blutlinien aufweist, oder umgekehrt die Kit-Mutation auf die Mastzelllinie beschränken.
Ähnlich wie Gewebsmakrophagen haben Mastzellen eine duale Herkunft und werden durch zwei unabhängige Wellen der Blutbildung gebildet. Die frühe embryonale Welle der Hämatopoese aus dem Dottersack besiedelt zunächst periphere Gewebe einschließlich der Haut mit Mastzellen, welche dann allerdings in später durch Mastzellen aus der definitiven Hämatopoese ausgetauscht werden. In einem laufenden Projekt untersuchen wir, wie die Ontogenese von Mastzellen die Wirkung einer somatischen KIT-Mutation verändert und möglicherweise den heterogenen Phänotyp und Verlauf der Mastozytose erklärt.