31.05.2021
Hydraulische Instabilität entscheidet über Leben und Tod
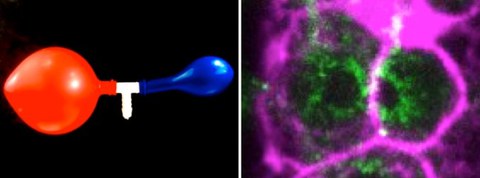
Links: Bild von zwei Ballons, die durch ein zentrales Rohr miteinander verbunden sind. Jede neue Luftzufuhr, die durch das weiße Rohr kommt, bläst den roten Ballon auf und nicht den blauen. Rechts: Konfokales Spinning-Disk-Bild von miteinander verbundenen C. elegans Keimzellen. Kortikales Aktin, das den Zellkortex zeigt, ist magentafarben markiert und Myosin, das die Keimzellenöffnungen abgrenzt, durch die beide Zellen zytoplasmatisches Material austauschen, ist in Grün markiert.
Dresdner Forscher:innen entdecken, dass ein mechanischer Vorgang der Entscheidung über das Absterben von Zellen zugrunde liegt.
Bei vielen Organismen, einschließlich des Menschen, sind die Keimzellen, die für die Fortpflanzung verantwortlich sind, miteinander verbunden und teilen sich ein gemeinsames Zellplasma. Im hermaphroditischen Fadenwurm Caenorhabditis elegans sind in der Gonade, dem Gewebe, das Ei- und Samenzellen produziert, bis zu 500 Keimzellen miteinander verbunden. Diese Zellen, die um einen zentralen zytoplasmatischen „Korridor“ angeordnet sind, tauschen zytoplasmatisches Material aus, was das Zellwachstum fördert, und schließlich befruchtungsreife Eizellen hervorbringt.
In vorangegangenen Studien haben Forscher:innen herausgefunden, dass die Gonade des C. elegans mehr Keimzellen erzeugt als benötigt werden und dass nur die Hälfte von ihnen zu Eizellen heranwächst, während der Rest kleiner wird und durch physiologische Apoptose abstirbt; einem programmierten Zelltod der in mehrzelligen Organismen auftritt. Nun haben Wissenschaftler:innen des Biotechnologischen Zentrums der TU Dresden (BIOTEC), des Max-Planck-Instituts für molekulare Zellbiologie und Genetik (MPI-CBG), des Exzellenzclusters Physik des Lebens (Physics of Life, PoL) an der TU Dresden, des Max-Planck-Instituts für Physik komplexer Systeme (MPI-PKS), des Flatiron Institute, NY, und der University of California, Berkeley, Hinweise auf die Frage gefunden, was diese Zellschicksalsentscheidung zwischen Leben und Tod in der Keimbahn auslöst.
Frühere Studien hatten bereits aufgezeigt, dass die physiologische Apoptose durch die genetische Basis und biochemische Signale vorangetrieben werden. Die Mechanismen, die über den Zelltod in einzelnen Keimzellen entscheiden und diesen einleiten, blieben jedoch bislang ungeklärt. Während des Reifungsprozesses entlang der Gonade des Fadenwurms wachsen die Keimzellen zunächst kollektiv homogen in Größe und Volumen. In der kürzlich veröffentlichten Studie in Nature Physics zeigen die Wissenschaftler:innen nun, dass dieses homogene Wachstum plötzlich in ein heterogenes Wachstum umschlägt, bei dem einige Zellen größer und andere Zellen kleiner werden.
Der Forscher Nicolas Chartier in der Forschungsgruppe von Stephan Grill, und Co-Erstautor der Studie, erklärt: „Durch die genaue Analyse der Keimzellvolumina und der zytoplasmatischen Materialflüsse in lebenden Würmern, sowie durch die Entwicklung einer theoretischen Modellierung, haben wir eine hydraulische Instabilität ausgemacht. Diese verstärkt kleine, anfangs zufällige, Volumenunterschiede und führt dazu, dass einige Keimzellen ihr Volumen auf Kosten der anderen Zellen vergrößern. Es handelt sich um ein Phänomen, das mit der unter Physikern bekannten Zwei-Ballon-Instabilität verglichen werden kann. Eine solche Instabilität entsteht, wenn man gleichzeitig in zwei Gummiballons pustet und versucht, sie beide aufzublasen. Nur der größere Ballon wird dabei aufblähen, weil er einen geringeren Innendruck hat als der kleinere und sich daher leichter aufblasen lässt.“ Und genau darum geht es bei der Selektion von Keimzellen: solche Druckunterschiede können die symmetrische Konfiguration mit gleichen Keimzellvolumina destabilisieren. Man spricht dann von hydraulischen Instabilitäten, die zum Wachstum der größeren Keimzelle auf Kosten der kleineren führen. Durch die künstliche Verringerung des Volumens von Keimzellen mittels thermoviskosem Pumpen (FLUCS-Methode: focused-light-induced cytoplasmic streaming) konnte das Team zeigen, dass eben diese Verringerung des Zellvolumens zum Zellausstoß und schließlich zum Zelltod führt. Dies deutet darauf hin, dass, sobald eine Zelle eine kritische Größe unterschreitet, die Apoptose eingeleitet wird und die Zelle abstirbt.
Mit Hilfe der konfokalen Bildgebung konnten die Forscher:innen den gesamten Organismus des lebenden Wurms abbilden, um ein globales und präzises Bild der Volumina aller Keimdrüsenzellen sowie des Flüssigkeitsaustauschs zwischen den Zellen zu erhalten. Stephan Grill, Sprecher des Exzellenzclusters Physics of Life (PoL) und Leiter der multidisziplinären Arbeit, fügt hinzu: „Diese Erkenntnisse sind sehr spannend, denn sie zeigen, dass die Entscheidung über Leben und Tod in den Zellen mechanischer Natur ist und mit der Gewebehydraulik zusammenhängt. Dies hilft uns zu verstehen, wie der Organismus eine Zelle automatisch auswählt, die zu einer Eizelle wird. Darüber hinaus ist die Studie ein weiteres Beispiel für die hervorragende Zusammenarbeit zwischen Biologen, Physikern und Mathematikern in Dresden.“
Originalpublikation:
Nicolas T. Chartier, Arghyadip Mukherjee, Julia Pfanzelter, Sebastian Fürthauer, Ben T. Larson, Anatol W. Fritsch, Rana Amini, Moritz Kreysing, Frank Jülicher & Stephan W. Grill A hydraulic instability drives the cell death decision in the nematode germline
Nature Physics (Mai 2021)
doi: https://doi.org/10.1038/s41567-021-01235-x
Weitere Informationen:
Prof. Stephan Grill
Sprecher des Exzellenzclusters Physics of Life (PoL) und Direktor am Max-Planck-Institut für molekulare Zellbiologie und Genetik (MPI-CBG)
E-mail:
