27.05.2016
DFG verlängert zwei Sonderforschungsbereiche der TU Dresden
DFG bewilligt der TU Dresden Verlängerung für zwei Sonderforschungsbereiche in den Feldern Psychologie und Medizin
Wie die Deutsche Forschungsgemeinschaft (DFG) heute (27. Mai 2016) mitteilte, werden die Sonderforschungsbereiche (SFB) 940 „Volition und kognitive Kontrolle“ der Fachrichtung Psychologie und der SFB/Transregio 127 „Biologie der Xenogenen Zell-, Gewebe- und Organtransplantation von der Grundlagenforschung zur klinischen Anwendung“ für vier Jahre verlängert.
SFB 940 „Volition und kognitive Kontrolle“: Wie funktioniert die willentliche Kontrolle der eigenen Gefühle und Handlungen?
Welche kognitiven Prozesse und neuronalen Systeme liegen der Fähigkeit zugrunde, die eigenen Handlungen und Gefühle willentlich zu kontrollieren? Warum gelingt es Menschen bei der Verfolgung wichtiger Ziele häufig nicht, kurzfristigen Versuchungen zu widerstehen oder eingeschliffene Gewohnheiten zu überwinden? Warum kommt es bei vielen psychischen Störungen (z.B. Suchterkrankungen oder Essstörungen) zu massiven Beeinträchtigungen der willentlichen Selbststeuerung? Dies sind Fragen, die in dem von der DFG seit 2012 geförderten SFB 940 „Volition und kognitive Kontrolle: Mechanismen, Modulatoren, Dysfunktionen“ von einem interdisziplinären Forscherteam aus Psychologen, Medizinern und Neurowissenschaftlern der TUD mit Kooperationspartnern der Charité Berlin unter der Leitung von Prof. Thomas Goschke zusammen untersucht werden. Aufgrund der exzellenten Bewertung des SFBs durch ein internationales Gutachtergremium hat die DFG nun die zweite vierjährige Förderperiode mit einem Fördervolumen von über 10 Millionen Euro bewilligt.
Das Ziel des SFBs besteht darin, die kognitiven und neuronalen Mechanismen zu entschlüsseln, die der Fähigkeit zur willentlichen Kontrolle der eigenen Handlungen und Gefühle zugrunde liegen und zu verstehen, wie es zu Beeinträchtigungen der Selbststeuerungsfähigkeit kommt. Die Fähigkeit, Verhalten an langfristigen Zielen und sozialen Normen auszurichten und dazu wenn nötig impulsive Reaktionen oder starke Gewohnheiten zu unterdrücken, ist die Grundlage persönlicher Autonomie und eine der beeindruckendsten, aber nach wie vor unzureichend verstandenen Leistungen, zu denen uns unser Gehirn befähigt. Gleichzeitig sind Störungen der Selbstkontrolle ein zentrales Merkmal vieler schädlicher Verhaltensweisen (z.B. ungesunde Ernährung, impulsive Aggression, Substanzmissbrauch oder pathologisches Spielen), die immense persönliche und gesellschaftliche Kosten verursachen. Das Thema des SFBs ist insofern sowohl für die Grundlagenforschung als auch für praktische Anwendungsfelder von zentraler Bedeutung.
In der ersten vierjährigen Förderperiode hat der SFB zahlreiche neue Einsichten in die Grundlagen der willentlichen Handlungssteuerung geliefert. So gelang es beispielsweise mit Hilfe funktioneller Bildgebungsmethoden, Regionen im Frontalhirn zu identifizieren, in denen Absichten vor ihrer Ausführung aufrechterhalten und wenn nötig gegen den Einfluss störender Umweltreize oder unerwünschter Handlungsimpulse abgeschirmt werden. Darüber hinaus wurden große Fortschritte bei der Entschlüsselung der neuronalen Systeme gemacht, die der Steuerung flexibler zielgerichteter Handlungen im Unterschied zu automatisierten Gewohnheiten zugrunde liegen. Von besonderer Bedeutung ist, dass Ergebnisse der Grundlagenforschung bereits geholfen haben, besser zu verstehen, warum es im Alltag zu Beeinträchtigungen der Selbstkontrolle kommt. Wie der Sprecher des SFBs, Prof. Thomas Goschke, erläutert, liefern diese Ergebnisse wichtige Belege dafür, dass kognitive und neuronale Mechanismen, die unter relativ künstlichen Laborbedingungen untersucht werden, Beeinträchtigungen der Selbstkontrolle im Alltag von Menschen vorhersagen.
In der zweiten Förderperiode wollen die Wissenschaftler darauf aufbauend untersuchen, ob sich anhand dieser gestörten neurokognitiven Prozesse langfristig das Risiko von Suchterkrankungen prognostizieren lässt und warum es insbesondere unter chronischem Stress zu Beeinträchtigungen der Selbstkontrolle kommt. Weitere Fragen werden sein, wie die willentliche Handlungssteuerung durch bestimmte Neurotransmittersysteme beeinflusst wird, wie sich die Handlungskontrolle über die Lebensspanne verändert und welche Mechanismen Beeinträchtigungen der Selbststeuerung bei Angst- und Essstörungen zugrunde liegen.
Thomas Goschke betont, dass der Erfolg des SFBs nicht zuletzt darauf beruht, dass er sich synergistisch in das exzellente Forschungsumfeld der TU Dresden einfügt und als international sichtbares Forschungszentrum bereits nachhaltig die Strukturbildung befördert hat. Besonders hebt er das integrierte Graduiertenkolleg zur Förderung einer strukturierten Doktorandenausbildung hervor sowie den Umstand, dass der SFB durch die Integration exzellenter Nachwuchswissenschaftler als Projektleiter die frühzeitige Selbstständigkeit des wissenschaftlichen Nachwuchses fördert.
Langfristige Vision ist es laut Goschke, nicht nur neue Einsichten in die neurokognitiven Grundlagen der willentlichen Handlungssteuerung zu gewinnen, sondern auch Grundlagen für eine verbesserte Prävention und Therapie von Störungen der willentlichen Selbststeuerung zu legen und damit neue Impulse für den gesellschaftlichen und philosophischen Diskurs über die Willensfreiheit zu setzen.
Informationen für Journalisten:
Prof. Dr. Thomas Goschke
Tel.: +49 351 463 34695 oder +49 172 3554785
Sonderforschungsbereich/Transregio 127 „Biologie der Xenogenen Zell-, Gewebe- und Organtransplantation von der Grundlagenforschung zur klinischen Anwendung“
Dieser SFB zu neuen Transplantationswegen mit Tier-Geweben und –Organen wird für weitere vier Jahre mit mehr als 15 Millionen Euro gefördert. Beteiligt sind an diesem weltweit einmaligen Forschungsprogramm zur Xenotransplantation neben der Technischen Universität Dresden auch die Ludwig-Maximilians-Universität München, die TU München und die Medizinische Hochschule Hannover sowie weitere vier Forschungsinstitute. In das Projekt involviert ist auch das renommierte King‘s College London, das über den von der Medizinischen Fakultät Carl Gustav Carus initiierten TransCampus eng mit der TU Dresden verbunden ist. Dabei soll eine Lösung für den großen Mangel an Spenderorganen für Patienten mit Herzerkrankungen und Diabetes durch die Nutzung von genetisch veränderten Schweineorganen und Schweinezellen gefunden werden. Prof. Stefan Bornstein, der Standortsprecher in Dresden und Direktor der Medizinischen Klinik und Poliklinik III am Universitätsklinikum Carl Gustav Carus Dresden, und sein Diabetesteam erhalten mit dieser Förderung weltweit erstmals die Chance, Patienten mit Diabetes und schweren Blutzuckerschwankungen mittels einer Biokammer mit insulinproduzierenden Zellen vom Schwein eine neue Therapie anbieten zu können. Durch diese Förderung wird die Dresdner Hochschulmedizin mit der Medizinischen Fakultät und dem Universitätsklinikum Carl Gustav Carus Dresden als eines der führenden Diabeteszentren weiter gestärkt.
Organ- und Zelltransplantationen sind bei manchen chronischen Erkrankungen eine Behandlung der Wahl, bei denen andere Therapien keinen Erfolg (mehr) versprechen. Dies ist beispielsweise bei einer Leberzirrhose der Fall, einem drohenden oder bereits eingetretenen Nierenversagen oder bei einem Typ-1-Diabetes mellitus mit schwerem Krankheitsverlauf. Ins Spektrum der Transplantationen gehört auch die Inselzelltransplantation, die zurzeit deutschlandweit nur in Dresden angeboten wird. Dabei werden Insulin-produzierende Zellen aus einem Spenderorgan (Bauchspeicheldrüse) entnommen, aufwändig aufbereitet und anschließend dem Empfänger in die Leber gespritzt.
Mit Prof. Bornstein sind weitere Dresdner Spitzenmediziner in den SFB/Transregio 127 eingebunden, der eine Kooperation von Experten aus Grundlagen-, translationaler Forschung sowie Transplantationsmedizin ist. Prof. Bornstein: „Viele Menschen warten vergeblich auf ein lebensrettendes Organ, weil das Angebot an Spenderorganen viel geringer ist, als die Zahl der potenziellen Empfänger. Darum suchen wir neue Wege, die künftig mehr Menschen helfen können.“ Neue Transplantationswege erhoffen sich die Wissenschaftler durch die Erforschung xenogener Transplantationen oder Xenotransplantationen. Bei dieser Form der Transplantation gehören die Gewebe- oder Organ-Spender einer anderen Art an als die Empfänger.
Der Schwerpunkt des Dresdner Beitrags im deutschlandweiten Forschungsverbund liegt bei der Inselzelltransplantation. So beschäftigt sich ein Projekt des Dresdner Wissenschaftlers Prof. Triantafyllos Chavakis mit dem frühen Funktionsverlust transplantierter Inselzellen durch eine einsetzende Abstoßungsreaktion. Die Wissenschaftler haben hier die biologischen Mechanismen im Endothel (Gefäßwandauskleidung) der Leukozyten (weiße Blutkörperchen) im Blick.
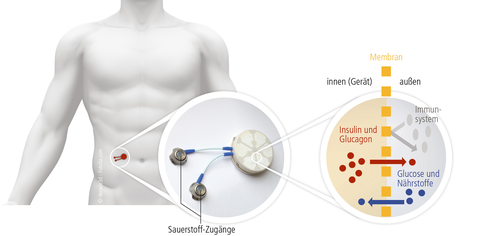
Ein weiteres Projekt der Forscher PD Dr. Barbara Ludwig, Prof. Stefan Bornstein sowie des TransCampus-Professors Mark Peakman vom King‘s College London beschäftigt sich mit der Entwicklung einer Kammer für Inselzellen, die Insulin-produzierende Zellen enthält und in den Körper des Empfängers eingesetzt wird. Entscheidender Vorteil dieser Kammer im Vergleich zur bisherigen Inseltransplantation soll sein, dass sie eine Immunisolation bietet. Der Empfänger bräuchte keine Immunsuppressiva mehr einzunehmen, da die Kammer zwar eine kontrollierte Sauerstoffversorgung der Inselzellen erlaubt und das produzierte Insulin aus der Kammer in den Körper leitet, die Inselzellen jedoch vor der Immunantwort des Empfängers, nämlich der Abstoßung der Zellen, schützt.
Das Modulieren früher und später Immunabstoßungen von xenogenen Inseltransplantaten in optimierten humanisierten Mäusen ist Gegenstand der Gruppe um Prof. Claudia Waskow, Privat-Dozentin Dr. Barbara Ludwig und Dr. Nikolai Klymiuk.
Ein weiteres viertes Projekt der Dresdner Forscher am CRTD und Paul Langerhans Institut Dresden unter der Leitung von Dr. Stephan Speier, Dr. Anthony Gavalas und Dr. Elisabeth Kemter beschäftigt sich mit der einmaligen Möglichkeit, das Überleben der insulinproduzierenden Langerhanschen Inseln in einem Transplantationsmodell im Augenhintergrund von Tieren darzustellen. Zusätzlich vergleichen die Wissenschaftler die Funktionsweise und die Effizienz von menschlichen Inselzellen mit denen von Inselzellen vom Schwein sowie von Inselzellen, die von menschlichen Stammzellen abgeleitet wurden.
Mit diesem Verbund ist Deutschland weltweit an vorderster Front, das Gebiet der Transplantationsmedizin entscheidend zum Wohl der Patienten voranzutreiben.
Internet: http://www.klinikum.uni-muenchen.de/SFB-TRR-127/de/index.html
Informationen für Journalisten:
Prof. Dr. med. Stefan R. Bornstein
Tel.: +49 (0) 351 458-5955