22.02.2024
Falscher Alarm des Immunsystems bei Muskelkrankheit

Gemeinsam gehen Prof. Claudia Günther (li) aus Dresden und Prof. Eva Bartok (re) aus Bonn dem Zusammenhang zwischen Myotoner Dystrophie und Autoimmunerkrankungen auf den Grund.
Neue Erkenntnisse über den Zusammenhang zwischen Myotoner Dystrophie und Autoimmunkrankheiten
(Bonn / Dresden) Forschende an den Universitätskliniken Dresden und Bonn aus dem DFG Transregio 237 sowie vom Exzellenzcluster ImmunoSensation2 der Universität Bonn klären, warum Personen mit myotoner Dystrophie 2 eine höhere Neigung zur Entwicklung von Autoimmunerkrankungen haben. Ihr Ziel ist es, die Entstehung der Krankheit zu verstehen. Die Ergebnisse der Studie eröffnen neue, potenzielle therapeutische Ziele, und sind jetzt im renommierten Fachjournal „Nature Communications“ veröffentlicht.
Myotone Dystrophie 2 (DM2) ist eine Form der Muskeldystrophie, eine Krankheit, die zu fortschreitender Muskeldegeneration führt. Sie wird durch die Ausdehnung einer sich wiederholenden DNA-Sequenz – hier die Abfolge der Nukleobasen CCTG – in einer Erbanlage, dem CNBP-Gen, verursacht. Generell trägt die Reihenfolge der Nukleobasen in der DNA die genetischen Informationen. Die Betroffenen leiden unter Muskelschwäche, die mehr im Bereich der rumpfnahen Muskulatur ausgeprägt ist, sowie anhaltender Muskelsteifigkeit und Schmerzen. Obwohl DM2 bei etwa einem von 10.000 Menschen in Deutschland auftritt, gibt es keine gezielten Therapien. In ersten Studien beobachteten Prof. Claudia Günther und ihr Team des Universitätsklinikums Carl Gustav Carus an der Technischen Universität Dresden auch, dass Personen mit DM2 mehr unter Autoimmunerkrankungen, die mit einer erhöhten Produktion von Antikörpern im Blut einhergehen, leiden als die Allgemeinbevölkerung. Der zugrundeliegende Mechanismus für diese Symptome war bisher jedoch unbekannt.
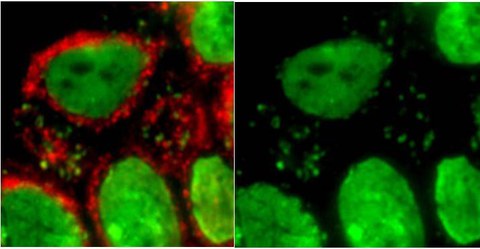
In das Zytoplasma ausgetretene DNA (grün) kolokalisiert mit dem DNA-Sensor cGAS (rot) in der Haut von Patienten mit myotoner Dystrophie Typ 2
Antivirale Reaktion ohne Virus
Zusätzlich zu den höheren Raten von Autoimmunität, also einer gestörten Tolleranz gegenüber bestimmten körpereigenen Stoffen, beobachtete Günthers Team eine ungewöhnliche Gensignatur in Zellen, die von DM2-Patienten stammen. „In den Patientenzellen waren Gene hochreguliert, die normalerweise für die Bekämpfung von Viren zuständig sind", so Erstautorin Sarah Rösing, Doktorandin in der Dresdner Arbeitsgruppe von Prof. Günther. „Wir haben schnell erkannt, dass dies eine wichtige Entdeckung ist. Diese Art der Immunantwort ist zwar gut, um Virusinfektionen zu bekämpfen, aber eine chronische Aktivierung ist oft mit Autoimmunität verbunden, sodass wir unbedingt verstehen mussten, woher sie kommt.” Um den Zusammenhang zwischen den erweiterten DNA-Wiederholungen (CCTG)n bei DM2-Patienten, der antiviralen Antwort und Autoimmunerkrankungen aufzuklären, untersuchten Forschende des DFG-geförderten Transregio 237 "Nukleinsäure-Immunität" an den Universitätskliniken Dresden und Bonn und des Exzellenzclusters ImmunoSensation2 der Universität Bonn gemeinsam die molekulare Signatur in Zellen von DM2-Patienten.
DM2-Zellen stehen unter chronischem Stress durch Junk-Proteine
In enger Zusammenarbeit zeigten die Forschenden in Dresden und Bonn, dass in den Zellen von DM2-Patienten die DNA-Wiederholungen (CCTG)n in toxische Nonsense-Proteine übersetzt werden. Deren Bildung führt zu einer chronischen Form von Stress des endoplasmatischen Retikulums (ER), einem verzweigten Gangsystem als Erweiterung der Kernmembran, und damit zu einer chronischen Schädigung der Mitochondrien, dem Energiekraftwerk der Zellen. „Mitochondrienschäden und ER-Stress in unseren Zellen sind klare Signale, dass etwas nicht stimmt", kommentiert Prof. Eva Bartok, Leiterin des Teams der Forschenden aus Bonn und eine der beiden Hauptautorinnen der Publikation, "diese Art von Stress kann durchaus wie eine Virusinfektion aussehen und eine antivirale Reaktion auslösen".
Zellulärer Stress löst die Immunreaktion aus
Diese "gestressten Mitochondrien" setzen kleine Mengen an DNA in der Zelle frei, die dann vom angeborenen Immunsystem als Gefahrensignal erkannt werden. Denn die cGAMP-Synthase (cGAS), ein wichtiger DNA-Rezeptor des angeborenen Immunsystems, erkennt diese mitochondriale DNA und löst so einen Alarmzustand aus, der durch die Freisetzung von dem wichtigsten antiviralen Mediator, Interferon vom Typ I, vermittelt wird. „Das war unser Aha-Erlebnis", sagt Prof. Günther, korrespondierende Autorin der Publikation. "Wir haben einen Mechanismus und einen Weg erkannt, die uns jetzt neue Möglichkeiten für gezielte Therapien der Krankheit erschließen."
Bestätigung durch Untersuchungen und Ausblick
Diese wichtigen Erkenntnisse bieten neue Möglichkeiten, mit gezielten Therapien die Entstehung der Autoimmunerkrankung bei den Betroffenen zu unterdrücken. „Unsere Daten liefern eine wichtige Grundlage für die Hemmung von cGAS und des Typ-I-Interferon-Signalwegs bei Myotoner Dystrophie 2", kommentiert Prof. Bartok. „Es ist sehr spannend zu sehen, wie die Ergebnisse unserer Grundlagenforschung die Versorgung dieser Betroffenen potenziell verbessern könnten", schließt Prof. Günther.
Publikation: Sarah Rösing, Fabian Ullrich, Susann Meisterfeld, Franziska Schmidt, Laura Mlitzko, Marijana Croon, Ryan Nattrass, Nadia Eberl, Julia Mahlberg, Martin Schlee, Anja Wieland, Philipp Simon, Daniel Hilbig, Ulrike Reuner, Alexander Rapp, Julia Bremser, Peter Mirtschink, Stephan Drukewitz, Thomas Zillinger, Stefan Beissert, Katrin Paeschke, Gunther Hartmann, Aleksandra Trifunovic, Eva Bartok and Claudia Günther; Chronic endoplasmic reticulum stress in myotonic dystrophy type 2 promotes autoimmunity via mitochondrial DNA release; Nature Communications; DOI: 10.1038/s41467-024-45535-1
Wissenschaftlicher Kontakt:
Prof. Claudia Günther
Universitätsklinikum Dresden
Klinik und Poliklinik für Dermatologie
Prof. Eva Bartok
Universitätsklinikum Bonn
Institut für Experimentelle Hämatologie und Transfusionsmedizin
Exzellenzcluster ImmunoSensation2, Universität Bonn
Tel.: +49 228 287-16730
