Schwerpunkt der Forschungsarbeit
Prof. Ünal Coskun ist der Gründer und Leiter des Zentrums für Membranbiochemie und Lipidforschung (ZML). Er leitet die Gruppe für Membranbiochemie.
Der Ausgangspunkt meines neuen Forschungsinteresses waren zwei grundlegende Fragen:
- Warum investieren eukaryotische Organismen so viel Energie in die Synthetisierung einer unglaublichen Vielfalt an Lipiden, wenn nur ein Lipid genügt, um eine funktionale Membrandoppelschicht zu bilden?
- Und, wenn Proteine und Lipide sich gemeinsam entwickelt haben, was sind die Konsequenzen von spezifischen Protein-Lipid-Wechselwirkungen für Proteinregulierung sowie Membran-Targeting von Proteinen?
Das Verständnis der biologischen Aktivität der Lipide auf die Proteinstruktur und Funktion ist ein neues Gebiet, von dem zu erwarten ist, dass es entscheidende Beiträge zu unserem Verständnis wichtiger zellbiologischer Prozesse liefern wird (Coskun und Simons, 2011, Structure). Das übergreifende Thema meiner Forschungsgruppe ist Membranbiochemie der zellulären Signalgebung. Wir untersuchen die wechselseitige Abhängigkeit von Lipid-Protein-Wechselwirkungen durch einen interdisziplinären Ansatz, der Zellbiologie und synthetische Biologie sowie Proteinbiochemie, Strukturbiologie und Biophysik verbindet. Unsere große Expertise ermöglicht es uns, Phänomene, die auf Lipid-Protein-Wechselwirkung basieren, auf unterschiedlichen Ebenen zu studieren − vom Organ und von Zellsystemen hinab zu minimal synthetischen Systemen, in denen wir sowohl die Proteine als auch die Lipide kontrollieren können, zum Beispiel, um die allosterischen Wirkungen bestimmter Lipide auf grundlegende Rezeptoren wie den EGF-Rezeptor (Coskun et al., 2011, PNAS) und den Insulinrezeptor zu beobachten.
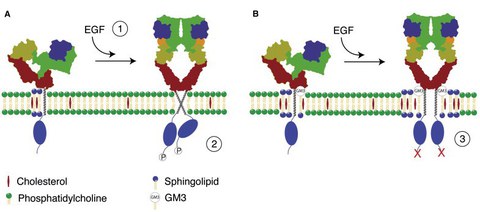
Proposed allosteric inhibition scheme of EGF receptor kinase activation by the ganglioside GM3 (A) EGF receptor association with sphingolipid/cholesterol domains prevents aberrant activation of EGFR signaling. EGF ligand binding promotes EGFR dimerization (1) leading to the formation of an active dimer (2). (B) When GM3 is present in the bilayer, the direct association of GM3 with the EGFR ectodomain leads to the inactivation of the EGFR kinase activity (3). For details please read Coskun and Simons (2011) Structure © Coskun
Dieser Ansatz, auf unterschiedlichen Ebenen zu arbeiten, erlaubt uns auch, den Fokus darauf zu richten, dass wir die Pathologie von Erkrankungen wie Diabetes aus einer membran-biochemischen Perspektive verstehen.
Eine noch offene Kernfrage in der Diabetesforschung ist, wie Betazellen zwischen Proliferation und der Produktion von insulin-sekretorischem Granulat (ISG) wählen. Außerdem bleibt es unklar, wie Betazellen eine abgestufte Reaktion auf Insulin erzeugen oder sogar empfindlich dafür bleiben können, wobei sie möglicherweise weit größeren Konzentrationen des Hormons als andere Zelltypen, wie beispielsweise Adipozyten oder Muskelzellen, ausgesetzt sind. Ein Teil der Erklärung könnten die Veränderungen in der Lipidzusammensetzung der Plasmamembran sein, die den Sekretionsprozesses begleiten und zu Veränderungen der Signaleigenschaften der Rezeptoren führen, die an der Plasmamembran (IGF-1R, IR) vorliegen. Könnten Lipid-Veränderungen in der Plasmamembran von sekretorischen Betazellen verantwortlich für die Modulation der zellulären Reaktion auf Insulinexposition sein?