Feb 06, 2018
Kooperation von MPI-CBG, Mathematik und Biotechnologie gelingt revolutionäre Steuerung embryonaler Entwicklung
Ein revolutionärer Ansatz zur Steuerung embryonaler Entwicklung
Dresdner Forscher induzieren Flüsse in Embryonen, um so deren Entwicklung zu steuern.
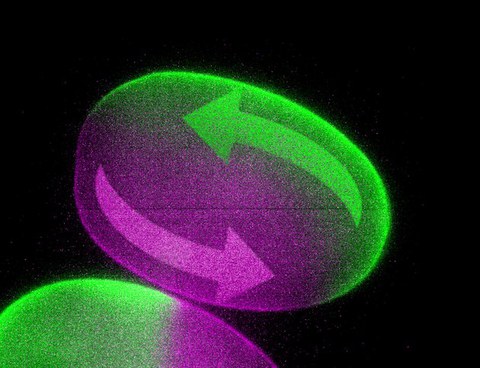
Einfache Bewegungen innerhalb biologischer Zellen, wie kleine Strömungen des flüssigen Zytoplasmas, sind vermutlich essenziell für die embryonale Entwicklung komplexer Organismen. Direkt geprüft werden konnte diese Annahme lange nicht, da geeignete Methoden fehlten, intrazelluläre Strömungen gezielt zu verändern. Dies gelang nun einem Forscherteam des Max-Planck-Instituts für molekulare Zellbiologie und Genetik (MPI-CBG) um Dr. Moritz Kreysing in Zusammenarbeit mit weiteren Gruppen am MPI-CBG, der Fakultät für Mathematik und dem Biotechnologischen Zentrum der TU Dresden: Sie fanden erstmals eine Möglichkeit, Bewegungen in lebendigen Zellen und Embryonen zu beeinflussen und gerichtet zu steuern. Die Biophysikgruppe griff mit dieser neuartigen zellbiologischen Technik in zentrale Entwicklungsprozesse von Embryonen aktiv ein. Ihre Studie validiert Hypothesen zur Polarisation von befruchteten Eizellen und verdeutlicht zugleich, dass die Zukunft der Mikroskopie interaktiv ist. Diese Ergebnisse wurden in der aktuellen Ausgabe der Fachzeitschrift Nature Cell Biology veröffentlicht.
Eine zentrale Frage der Biologie ist, wie sich aus einer befruchteten Eizelle ein kompletter Organismus entwickeln kann. Die molekularbiologische Forschung ermöglichte in den letzten Jahren tiefe Einblicke in dieses Phänomen embryonaler Entwicklung. Ein zentraler Aspekt jedoch blieb unbeantwortet und war methodisch sehr schwer zugänglich. Damit sich ein Organismus korrekt entwickeln kann, müssen Biomoleküle an die richtigen Stellen des wachsenden Embryos gelangen, ähnlich wie Baumaterial auf einer Baustelle. Ein frühes und wichtiges Beispiel für diese Umverteilung von Material ist die biochemische Polarisation befruchteter Eizellen. Dieser Prozess definiert die spätere Körperachse des Tiers, d.h. zum Beispiel wo der Kopf eines Wurmes und wo sein Schwanz wachsen wird. Durch welche Mechanismen polarisationsrelevante Moleküle verteilt werden, blieb jedoch lange unbeantwortet, da eine geeignete Methode fehlte, schonend in den intrazellulären Transport lebender Embryos einzugreifen.
Dem Forscherteam um Dr. Moritz Kreysing ist es nun gelungen, mit ihrer nicht-invasiven Lasertechnologie FLUCS (englisch:“focused-light-induced-cytoplasmic-streaming“) kontrollierte Ströme in lebenden Embryonen zu erzeugen. Mit diesem revolutionären Werkzeug konnten die Forscher die Bedeutung der Bewegung des Zytoplasmas für die Polarisation der Eizelle testen und somit bestehende Hypothesen validieren und ergänzen.
Matthäus Mittasch, Doktorand und Erstautor der Studie, schwärmt: „Mit FLUCS wird die Mikroskopie sich entwickelnder Embryonen plötzlich interaktiv“. Und tatsächlich: Angeleitet durch realistische Computersimulationen gelang es den Forschern sogar, die Körperachse von Wurm-Embryonen mit Hilfe von FLUCS umzukehren, was die räumlich gespiegelte Entwicklung des Wurms einleitete. Forschungsgruppeleiter Moritz Kreysing, der auch dem Zentrum für Systembiologie Dresden angehört, kommt zu dem Schluss: „Die Möglichkeit das Innere von Zellen zu bewegen wird grundlegend zum Verständnis beitragen wie sich Zellen bewegen, wie sie auf externe Signale reagieren und wie sie sich teilen. Weiterhin eröffnet sich mit FLUCS erstmals die Möglichkeit, experimentell nachzuvollziehen wie lebende Organismen aus der Interaktion biochemischer Reaktionen und physikalischer Bewegung hervorgehen.“
Forscher sind sich einig: In der Medizin hat FLUCS das Potenzial, embryonale Entwicklungsstörungen besser zu verstehen, In-vitro-Fertilisation zu verbessern und die Erprobung neuer Medikamente zu vereinfachen.
Original Publication
“Non-invasive perturbations of intracellular flow reveal physical principles of cell organization.” Matthäus Mittasch, Peter Groß, Michael Nestler, Anatol W. Fritsch, Christiane Iserman, Mrityunjoy Kar, Matthias Munder, Axel Voigt, Simon Alberti, Stephan W. Grill, and Moritz Kreysing: Nature Cell Biology, 20(3), 2018.
Link zum Artikel in Nature Cell Biology https://dx.doi.org/10.1038/s41556-017-0032-9
Informationen für Journalisten:
Prof. Axel Voigt
Fakultät Mathematik, Institut für Wissenschaftliches Rechnen
Tel.: +49(0) 351 463-34187