28.04.2023
Eine süße Lösung für ein hartes Problem: Neue, bioinspirierte Moleküle als Turbo der Knochenregeneration
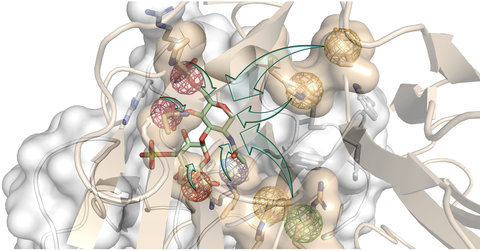
Schematische Darstellung des computergestützten strukturbasierten rationalen Designs. Die grünen Pfeile symbolisieren eine innovative Strategie zur Einführung neuer chemischer Eigenschaften in das Hyaluronsäure-Molekül (grüne und rote Stäbchen), um rationell konstruierte GAG-Moleküle (REGAG) zu entwickeln, die Proteine ausschalten, die die Knochenregeneration blockieren.
Ein interdisziplinäres Forschungsteam in Dresden hat neuartige bioinspirierte Moleküle auf Zuckerbasis entwickelt, welche die Knochenregeneration verbessern könnten.
Die Fähigkeit des Menschen, Knochen stetig zu erneuern und somit widerstandsfähig zu halten, nimmt mit zunehmendem Alter ab und wird durch Krankheiten wie Osteoporose weiter eingeschränkt. Um der alternden Bevölkerung zu helfen, suchen Forscherinnen und Forscher nach neuen Therapien zur Verbesserung der Knochenregeneration. Ein interdisziplinäres Team des Biotechnologischen Zentrums (BIOTEC), der Medizinischen Fakultät und des Max-Bergmann-Centrums für Biomaterialien (MBC) der TU Dresden hat nun neuartige bioinspirierte Moleküle entwickelt, welche die Knochenregeneration bei Mäusen verbessern. Die Ergebnisse wurden in der Fachzeitschrift Biomaterials veröffentlicht.
Mit zunehmendem Alter nimmt die Fähigkeit des Menschen ab, seine Knochen zu regenerieren. Knochenbrüche heilen langsamer und Krankheiten wie Osteoporose treten häufiger auf. Dies stellt eine große gesundheitliche Herausforderung für die alternde Bevölkerung und eine zunehmende sozioökonomische Belastung für die Gesellschaft dar. Um dieses Problem anzugehen, suchen Forschungsteams nach neuen therapeutischen Ansätzen, welche die Knochenregeneration verbessern können.
Ein Team aus Dresden hat mit Hilfe von Computermodellen und Simulationen neuartige bioinspirierte Moleküle entwickelt, welche die Knochenregeneration bei Mäusen verbessern. Sie können in Biomaterialien eingebunden und somit lokal in Knochendefekte eingebracht werden. Die neuartigen Moleküle basieren auf Glykosaminoglykanen, langkettigen Zuckern wie Hyaluronsäure oder Heparin.
Eine süße Lösung als Knochenheilungsturbo

Das Team: Prof. Maria Teresa Pisabarro, Dr. Gloria Ruiz Gómez, Dr. Juliane Salbach-Hirsch und Prof. Lorenz Hofbauer (v.l.n.r.)
„Dank der Arbeit unserer Gruppe und anderer Gruppen kennen wir einen bestimmten molekularen Weg, den Wnt-Signalweg, der die Knochenbildung und -reparatur reguliert. Wir konnten ihn auf zwei Bremssignale eingrenzen, die gemeinsam die Knochenregeneration blockieren: Sclerostin und Dickkopf-1", erklärt Prof. Lorenz Hofbauer. "Die große Herausforderung für die Entwicklung von Medikamenten, zur Verbesserung der Knochenheilung, besteht darin, diese beiden Blockade-Proteine gleichzeitig und effizient auszuschalten.“
Ein interdisziplinärer Ansatz war der Schlüssel zum Erfolg. Die Gruppe Strukturelle Bioinformatik unter der Leitung von Prof. Maria Teresa Pisabarro am Biotechnologischen Zentrum (BIOTEC) der TU Dresden und die Gruppe Funktionelle Biomaterialien von PD Dr. Vera Hintze vom Max-Bergmann-Zentrum für Biomaterialien, Institut für Werkstoffwissenschaft bündelten ihre Expertise mit dem Knochenexperten Prof. Lorenz Hofbauer von der Medizinischen Fakultät der TU Dresden.
„Seit mehreren Jahren nutzen wir die Möglichkeiten der Computersimulation, um zu untersuchen, wie Proteine, welche die Knochenbildung regulieren, mit ihren Rezeptoren interagieren. All dies mit dem Ziel, neuartige Moleküle zu entwerfen, welche diese Interaktionen gezielt beeinflussen können. Wir arbeiteten im Tandem zwischen Computer und Labor, entwarfen und testeten neuartige Moleküle, übertrugen die Ergebnisse auf unsere molekularen Modelle und lernten mehr über die molekularen Eigenschaften, die für unser Ziel erforderlich waren", erklärt Prof. Pisabarro.
Das Team von Prof. Hofbauers Bone Lab setzte schließlich mit diesen Molekülen beladene Biomaterialien bei Knochendefekten in Mäusen ein, um ihre Wirksamkeit zu testen. Dabei erwiesen sich die mit den neuen Moleküle beladenen Materialien im Vergleich zum Standard-Biomaterial als deutlich wirksamer und steigerten die Knochenheilung um bis zu 50 %, was auf ein enormes regeneratives Potenzial hinweist.
Wertschöpfungskette: Vom Computer ins Labor und zurück
Das multidisziplinäre Team nutzte rationales Wirkstoffdesign, um neuartige Moleküle mit maßgeschneiderten Eigenschaften und minimalen Nebenwirkungen zu entwickeln. Durch den Einsatz von Berechnungsmethoden zur Vorhersage und Verfeinerung der Eigenschaften der entworfenen Moleküle konnte das Team eine Reihe von Kandidaten entwickeln, die das größte Potenzial haben, die Proteine auszuschalten, und die Knochenregeneration zu blockieren.
Die Expertise der Gruppe Pisabarro ermöglichte eine detaillierte Analyse der dreidimensionalen (3D) Strukturen der beiden Proteine, die die Knochenregeneration blockieren. Auf diese Weise konnten sie die Interaktion der Proteine mit ihren Rezeptoren in 3D modellieren und Schlüsselstrukturen identifizieren, d.h. spezifische physikalisch-chemische und dynamische Eigenschaften, die für die biologische Interaktion wesentlich sind.
„Mit Hilfe von Molecular Modelling haben wir neue Strukturen entworfen, welche die relevanten Rezeptorinteraktionen mit den beiden Proteinen nachahmen. Wir wollten, dass diese Bindung stärker ist als ihre natürlichen Wechselwirkungen. Auf diese Weise würden unsere neuen Moleküle die Proteine sowohl einfangen und effektiv ausschalten und dadurch die Knochenregeneration fördern", erklärt Prof. Pisabarro.
„Die von Prof. Pisabarros Gruppe entworfenen Moleküle wurden von unseren Kollegen an der Freien Universität Berlin synthetisiert und dann von uns in Bezug auf ihre Proteinbindungseigenschaften mittels biophysikalischer Interaktionsanalyse untersucht ", sagt PD Dr. Hintze. "Für jedes Molekül konnten wir messen, wie stark es an die Proteine bindet sowie mit der Bindung der Proteine an ihre natürlichen Rezeptoren interferiert. Auf diese Weise konnten wir empirisch zeigen wie effektiv sie damit die hemmenden Proteine ausschalten. Die biologische Relevanz dieser Wechselwirkungsstudien testete Hofbauers Gruppe in einem Zellkulturmodell und später in Mäusen.
Die Ergebnisse dieser iterativen Tests sind von großem Wert, um die derzeitigen molekularen Modelle der Pisabarro-Gruppe zu verbessern und als Blaupause für die Entwicklung neuartiger und besserer Moleküle in der Zukunft zu dienen. Ein solcher Ansatz stellt auch sicher, dass Tierversuche auf ein Minimum reduziert werden und erst in der Endphase des Projekts zum Einsatz kommen.
Auf dem Weg zur Arzneimittelentwicklung
Die Ergebnisse des Teams stellen einen aufregenden Schritt mit beträchtlicher klinischer Relevanz dar. Die neu entwickelten Moleküle könnten dazu verwendet werden, Proteine auszuschalten, die die Knochenregeneration blockieren, und zur Entwicklung neuer, wirksamerer Therapien für Knochenbrüche und andere Knochenerkrankungen führen.
Das Team setzt seine erfolgreiche Zusammenarbeit fort. „Wir beantragen die Finanzierung einer präklinischen Studie, um diese Moleküle als innovative Therapie für eine Studie an Menschen weiterzuentwickeln", sagt Prof. Hofbauer.
Interdisziplinarität fördern
Die Forschungsarbeiten wurden von der Deutschen Forschungsgemeinschaft (DFG) gefördert. Die Gruppen waren Teil des Transregio 67-Sonderforschungsbereichs "Funktionelle Biomaterialien zur Steuerung von Heilungsprozessen in Knochen- und Hautgewebe - vom Material zur Klinik (Dresden/Leipzig; 59307082—TRR67 Teilprojekte A3, A7, A8, B2 and Z3)". Über einen Zeitraum von mehr als 12 Jahren haben die drei Partner in Kooperation mit anderen Gruppen in Deutschland neue Erkenntnisse, Techniken und das notwendige Know-how erarbeitet, um das Problem der Knochenregeneration anzugehen.
Originalveröffentlichung
Gloria Ruiz-Gómez, Juliane Salbach-Hirsch, Jan-Niklas Dürig, Linda Köhler, Kanagasabai Balamurugan, Sandra Rother, Sophie-Luise Heidig, Stephanie Moeller, Matthias Schnabelrauch, Giulia Furesi, Sophie Pählig, Pedro M. Guillem-Gloria, Christine Hofbauer, Vera Hintze, M. Teresa Pisabarro, Jörg Rademann, Lorenz C. Hofbauer: Rational engineering of glycosaminoglycan-based Dickkopf-1 scavengers to improve bone regeneration. Biomaterials (April 2023)
Link: https://doi.org/10.1016/j.biomaterials.2023.122105
Link zum kostenlosen Download: https://authors.elsevier.com/c/1gtRyWWN0wUGo
Über das Biotechnologisches Zentrum (BIOTEC)
Das Biotechnologische Zentrum (BIOTEC) wurde 2000 als zentrale wissenschaftliche Einrichtung der TU Dresden mit dem Ziel gegründet, modernste Forschungsansätze in der Molekular- und Zellbiologie mit den in Dresden traditionell starken Ingenieurswissenschaften zu verbinden. Seit 2016 ist das BIOTEC eines von drei Instituten der zentralen wissenschaftlichen Einrichtung Center for Molecular and Cellular Bioengineering (CMCB) der TU Dresden. Das BIOTEC nimmt eine zentrale Position in Forschung und Lehre im Forschungsschwerpunkt Molecular Bioengineering ein und verbindet zellbiologische, biophysikalische und bioinformatische Ansätze miteinander. Es trägt damit entscheidend zur Profilierung der TU Dresden im Bereich Gesundheitswissenschaften, Biomedizin und Bioengineering bei.
www.tud.de/biotec
www.tud.de/cmcb
Medizinische Fakultät Carl Gustav Carus der Technischen Universität Dresden
Die Dresdner Universitätsmedizin, bestehend aus der Medizinischen Fakultät Carl Gustav Carus und dem gleichnamigen Universitätsklinikum, hat sich auf die Forschung in den Bereichen Onkologie, Metabolismus sowie neurologische und psychiatrische Erkrankungen spezialisiert. Innerhalb dieser Schwerpunkte sind die Themen Degeneration und Regeneration, Bildgebung und Technologieentwicklung, Immunologie und Entzündungen sowie Prävention und Versorgungsforschung von besonderem Interesse. Internationalität ist eine Voraussetzung für Spitzenforschung - das Universitätsklinikum Dresden lebt dieses Konzept mit Mitarbeitern aus 73 Nationen und zahlreichen Kooperationen mit Forschungsteams aus aller Welt.
Max-Bergmann-Zentrum für Biomaterialien, Dresden
Das Max-Bergmann-Centrum für Biomaterialien (MBC) ist eine gemeinsame Forschungseinrichtung der TU Dresden (TUD) und des Leibniz-Instituts für Polymerforschung (IPF). Es wurde 2002 auf dem Campus des Leibniz-Instituts für Polymerforschung eröffnet. Unter dem gemeinsamen Dach eines eigenen Laborgebäudes vereint das Zentrum Forscher und Einrichtungen des Instituts für Werkstoffwissenschaft der TUD und des IPF, um an biologisch inspirierten Materialien zu arbeiten. Die daraus resultierenden Herausforderungen verknüpfen wissenschaftlichen Fortschritt mit industrieller Innovation und erfordern einen kollaborativen, multidisziplinären Ansatz sowie die Zusammenarbeit über traditionelle Strukturen hinweg – dafür steht der MBC. MBC-Wissenschaftlerinnen und -Wissenschaftler beteiligen sich aktiv am Zentrum für Regenerative Therapien Dresden (CRTD) und am Innovationszentrum für Molekulares Bioengineering (B CUBE).
www.mbc-dresden.de
Zusätzliche Materialien:
Website der Forschungsgruppe von Prof. Maria Teresa Pisabarro: https://tud.link/xksm
Website der Forschungsgruppe von Prof. Lorenz Hofbauer: https://bone-lab.de/
Bildmaterial: https://tud.link/tdrc
Wissenschaftlicher Ansprechpartner:innen:
Prof. Maria Teresa Pisabarro
Tel: +49 351 463 40071
Email:
