29.08.2016
Flexibel statt starr - Gezielter und effizienter Transport zellulärer Frachten durch physikalischen Mechanismus
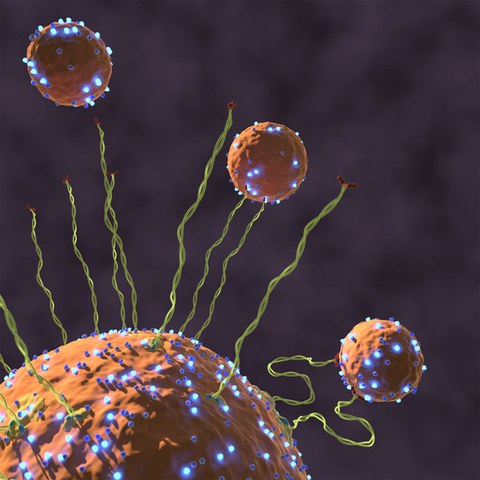
Ein Vesikel wird von einem Endosom mit dem Bindungsprotein EEA1 eingefangen und bindet an Rab5. Das aktive Rab5 (leuchtende blaue Partikel) veranlasst eine Veränderung der Flexibilität von EEA1 (grüne Filamente), wodurch das Vesikel zur Zielmembran gezogen werden, andocken und verschmelzen kann.
Damit Zellen richtig funktionieren können, müssen Frachten innerhalb der Zelle ständig von einem Ort zum anderen transportiert werden, wobei es ähnlich zugeht wie an einem Güterbahnhof. Diese Frachten befinden sich entweder innerhalb oder auf intrazellulären Membranen sogenannter Vesikel. Diese Membranen haben eine spezifische Signatur und nur diejenigen mit der richtigen Signatur können mit Membranen anderer Zellorganellen zu einem Zellkompartiment verschmelzen. Dazu müssen die Vesikel von der Zielmembran erkannt werden, wozu diese lange Bindungsproteine verwendet, um das passende Vesikel zu finden.
David Murray und Marcus Jahnel aus den Forschungsgruppen von Marino Zerial am Max-Planck-Institut für molekulare Zellbiologie und Genetik (MPI-CBG) und Stephan Grill vom Biotechnologischen Zentrum der TU Dresden wollten herausfinden wie diese langen Bindungsproteine in der Lage sind die Signatur eines Vesikels zu erkennen, um es zur Zielmembran zu ziehen. Die beiden Forscher und ihre Kollegen entdeckten, dass wenn ein Vesikel durch ein aktives Rab5, GTPase Protein andockt, dieses Protein eine Nachricht entlang des starren Bindungsproteins schickt, um es plötzlich flexibel zu machen. Diese Flexibilität ermöglicht es dem Vesikel hin zur Zielmembran zu wandern, dort anzudocken, und mit ihr zu verschmelzen. Dieser neu entdeckte Mechanismus wurde in der Fachzeitschrift Nature veröffentlicht und verdeutlicht, wie der Verkehr innerhalb einer Zelle effizient und gezielt ablaufen kann und löst das Paradox von Größenverhältnissen auf.
Original Publikation:
David H. Murray & Marcus Jahnel, Janelle Lauer, Mario J. Avellaneda, Nicolas Brouilly, Alice Cezanne, Hernán Morales-Navarrete, Enrico D. Perini, Charles Ferguson, Andrei N. Lupas, Yannis Kalaidzidis, Robert G. Parton, Stephan W. Grill and Marino Zerial: An endosomal tether undergoes an entropic collapse to bring vesicles together.
Nature, 24 August 2016, doi: 10.1038/nature19326
Nähere Information: Gruppenseite Stephan Grill
