05.02.2025
"Tubulin-Code" verantwortlich für Verhinderung von Frontalzusammenstößen in Zilien
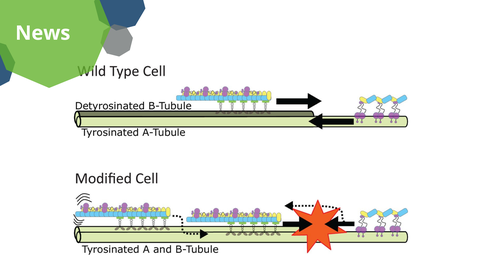
Das vorgeschlagene Modell für den Mechanismus des intraflagellären Transports. In Wildtypzellen bewegen sich die in Vorwärtsrichtung fahrenden Züge mit ihrer Ladung auf den detyrosinierten B-Tubulus. Währenddessen bleiben die beladenen Züge, die in Rückwärtsrichtung fahren, auf dem tyrosinierten A-Tubulus. In den modifizierten Zellen findet diese Trennung der Züge auf unterschiedliche Tubuli nicht statt, was Kollisionen und "Verkehrsstaus" zur Folge hat.
Durch die Entwicklung eines ausgefeilten In-vitro-Systems, welches fortschrittliche Bildgebungstechniken und CRISPR-Genomeditierung, kombiniert, erklärte ein internationales Forschungsteam des B CUBE – Center for Molecular Bioengineering der TU Dresden und des Human Technopole (Italien), wie Kollisionen zwischen molekularen Transportzügen, die sich in entgegensetzte Richtungen innerhalb des Ziliums bewegen, vermieden werden. Sie zeigten, dass posttranslationale Modifikationen von Tubulin für die Regulation der bidirektionalen Bewegung von Frachtzügen in Zilien verantwortlich sind. Die Forschung wurde vom ERC und dem DFG-Exzellenzcluster Physics of Life gefördert. Die Ergebnisse wurden in Nature Communications veröffentlicht.
Zilien sind haarähnliche Organellen, die sich an fast allen eukaryotischen Zellen befinden. Sie spielen eine entscheidende Rolle bei der Zellsignalübertragung, Bewegung und dem Flüssigkeitstransport. Der ordnungsgemäße Aufbau und die Funktion von Zilien sind auf ein ausgeklügeltes bidirektionales Transportsystem angewiesen, das als intraflagellärer Transport (IFT) bezeichnet wird. Störungen des intraflagellären Transports sind mit einer Vielzahl von Erkrankungen verbunden, die zusammenfassend als Ziliopathien bezeichnet werden. Zu diesen gehören Atemwegserkrankungen, Unfruchtbarkeit, Fettleibigkeit, Diabetes und Stoffwechselstörungen, Herz-Kreislauf-Erkrankungen, Beeinträchtigungen der Sinnesorgane und neurologische Störungen. Die Forschung an Zilien trägt dazu bei, die Mechanismen des Frachttransports besser zu verstehen und somit die Ursachen und potenziellen Behandlungsmethoden für diese Krankheiten zu erforschen.
Wie in einem Bahnhof nutzt das intraflagelläre Transportsystem Mikrotubuli als "Gleise", um den geordneten Transport von molekularer Fracht zwischen dem Zellkörper und der Spitze des Ziliums zu gewährleisten. Doch wie wird dieser komplexe Verkehr geregelt, und welche Mechanismen sorgen dafür, dass in entgegengesetzte Richtungen transportierte Frachten nicht kollidieren?
Posttranslationale Modifikation als Lösung
Die Gruppen von Stefan Diez, Professor für BioNano-Werkzeuge am B CUBE - Center for Molecular Bioengineering an der TU Dresden, und von Gaia Pigino, Associate Head des Structural Biology Research Centre am Human Technopole in Mailand, untersuchten die Rolle von posttranslationalen Tubulin-Modifikationen bei der Regulierung des intraflagellären Transports.
Die Forschenden zeigten, dass Detyrosinierung, eine Modifikation, die auf bestimmten Mikrotubuli innerhalb des Ziliums angereichert ist, für den reibungslosen Transportbetrieb entscheidend ist. Mithilfe von modifizierten Chlamydomonas reinhardtii Algen, denen die Tubulin-Detyrosinierung fehlte, beobachteten sie häufige Stopps von intraflagellären Transportzügen und eine Fehlleitung der Fracht. Diese Störungen verursachten Kollisionen zwischen Zügen, die sich in entgegengesetzte Richtungen bewegten, und behinderten das Zilienwachstum.
Weitere Experimente mit synthetischen Mikrotubuli in vitro zeigten, dass Vorwartszüge (die sich zur Zilienspitze bewegen) detyrosinierte Mikrotubuli den Vorzug geben. Im Gegensatz dazu bevorzugen Rückwartszüge (die sich zurück zum Zellkörper bewegen) tyrosinierte Mikrotubuli. Diese unterschiedliche Affinität hilft dabei, die beiden Zugtypen auf unterschiedliche Mikrotubuli zu verteilen und gewährleistet so einen kollisionsfreien Transport. In modifizierten Zellen war diese Trennung nicht mehr vorhanden, was zu einem "Verkehrsstau" und einer Funktionsbeeinträchtigung der Zilien führte.
Rekonstruktion des Transports außerhalb der Zelle
Diese Studie liefert den ersten Beweis dafür, dass Tubulin-Detyrosinierung mit der räumlichen Organisation von intraflagellären Transportzügen zusammenhängt. Darüber hinaus stellt die Studie eine hochmoderne Methode zur Rekonstruktion der Zugmotilität auf synthetischen Mikrotubuli vor und bietet so ein kontrolliertes System zur Untersuchung dieser Wechselwirkungen auf molekularer Ebene.
Der Ansatz zur Rekonstruktion des intraflagellären Transports in vitro bietet darüber hinaus eine vielseitige Plattform für zukünftige Forschungen, da diese Methode angepasst werden kann, um andere posttranslationale Modifikationen und ihre Auswirkungen auf Mikrotubuli-assoziierte Prozesse zu untersuchen.
„Diese Studie wäre ohne die Expertise unserer Partner nicht möglich gewesen“, betont Prof. Diez. „Die Zusammenarbeit mit der Pigino-Gruppe – zunächst am Max-Planck-Institut für Molekulare Zellbiologie und Genetik in Dresden und nun am Human Technopole in Italien – war eine äußerst bereichernde Erfahrung. In diesem Projekt wurden ihre Expertise in Molekularbiologie und Elektronenmikroskopie nahtlos mit unserer Erfahrung in In-vitro-Rekonstitution und Lichtmikroskopie vereint.“
Durch die Entdeckung, wie Tubulin-Modifikationen die Transportlogistik steuern, befasst sich die Studie mit einer seit langem bestehenden Frage im Bereich der Zilienbiologie. Die Ergebnisse können über die Grundlagenforschung hinaus Auswirkungen haben, da Defekte im ziliären Transport eine zentrale Rolle bei Ziliopathien spielen, wie z. B. der polyzystischen Nierenerkrankung, der primären Ziliendyskinesie und der Netzhautdegeneration.
Die Ergebnisse der Studie zeigen, wie wichtig die molekulare Feinabstimmung innerhalb von Zilien für ihre ordnungsgemäße Funktion ist, mit weitreichenden Implikationen für das Verständnis von Krankheiten, die über Ziliopathien hinausgehen, wie z. B. neurodegenerativer Erkrankungen und Krebs.
Originale Veröffentlichung:
Aditya Chhatre, Ludek Stepanek, Adrian Pascal Nievergelt, Gonzalo Alvarez Viar, Stefan Diez and Gaia Pigino: Tubulin tyrosination/detyrosination regulate the affinity and sorting of intraflagellar transport trains on axonemal microtubule doublets. Nature Communications (Januar 2025)
Link: https://doi.org/10.1038/s41467-025-56098-0
