Ziele
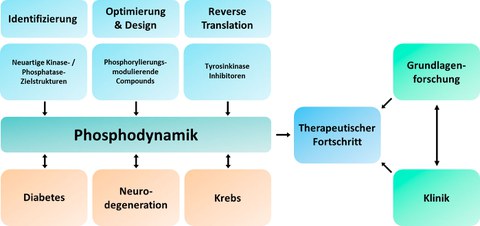
Die reversible Phosphorylierung von Proteinen ist ein zentrales Element der intrazellulären Signaltransduktion. Das Gleichgewicht von Phosphorylierung und Dephosphorylierung bestimmt maßgeblich über den Phosphorylierungsgrad und damit die Aktivität des jeweiligen Proteins. Eine Störung der Signaltransduktion über Phosphorylierungssignale tritt bei den großen Volkskrankheiten Krebs, Diabetes mellitus und neurodegenerative Erkrankungen auf und liegt diesen häufig zu Grunde. Besonders gut wurden diese Zusammenhänge im Bereich der Onkologie in die Klinik translatiert, wo viele Onkogene als Proteinkinasen identifiziert wurden und die Anwendung von Kinase-Inhibitoren teils spektakuläre Erfolge in der klinischen Anwendung erzielen konnte. Nicht zuletzt die Verfügbarkeit von zugelassenen Kinase-Inhibitoren hat zur Ausweitung der Anwendung auf andere Fachgebiete geführt. Hier konnten erste Erfolge bei der Behandlung von Diabetes mellitus Typ 1 und 2 durch TKIs erzielt werden. Auch eine Anwendung bei neurodegenerativen Erkrankungen wird derzeit erprobt; die vorläufigen Ergebnisse sowohl bei Morbus Parkinson als auch bei Amyotropher Lateralsklerose sind vielversprechend. An diesen Ausgangspunkt knüpfen die Ziele im Forschungskolleg an: Unter dem Titel "Phosphoproteom-Dynamik: Schlüssel für die Entwicklung neuartiger Wirkprinzipien und fachübergreifender Konzepte in der Krebs-, Neuro- und Diabetestherapie" sind neben der Identifikation von Kinasen oder Phosphatasen als vielversprechende Targets und der Entwicklung bzw. Modifikation von Wirkstoffen insbesondere die Erprobung von zugelassenen Wirkprinzipien in andere Fachbereiche ("Reverse Translation") ein Schwerpunkt im Forschungskolleg.
Das EKFK "Phosphoproteom-Dynamik" hat sich folgende Forschungsziele gesetzt:
I. Identifikation von Kinasen- und Phosphatasen als neuartige Zielstrukturen und Biomarker
Es werden durch den Einsatz bereits am Standort etablierter, innovativer Unbiased High-Throughput Screening - Verfahren neuartige Kinase- und Phosphatase-Zielstrukturen und Biomarker identifiziert und in der experimentellen und klinischen Erprobung validiert. Hierbei kann auf eine einzigartige Kombination aus etablierten Zelllinien und Primärzellen der verschiedenen klinischen Fachbereiche und State-of-the-Art Hochdurchsatz Screening Verfahren wie z.B. miRNA/shRNA/CRISPR-Cas9-basierter knock-down oder knock-out Modelle zurückgegriffen werden. In vitro - Effekte von identifizierten Kandidaten-Molekülen können in spezifischen Zellpopulationen mittels Kombination von Phänotypisierung und Proteom-Analyse (Cytometry Time of Flight, CyTOF ) untersucht werden. Eine weitere Strategie zur Etablierung neuartiger Kinase- und Phosphatase-modulierender Substanzen wird die Anwendung unterschiedlicher subzellulärer Interaktom-Verfahren (Split-Ubiquitin / Yeast two-Hybrid, BioID, Apex, etc.) sein. Diese Techniken erlauben auch, Zielproteine anzugreifen, die bisher als schwer „drugable“ galten. Nachfolgend steht ein in vivo Repertoire von Modellorganismen (Zebrafisch, Maus, humane induzierte pluripotente Stammzellen) bereit, um physiologische Effekte der putativen Wirkstoffe abzuschätzen.
II. Optimierung vorhandener und neuartiger Modulatoren von Kinasen und Phosphatasen
Es werden die bereits bekannten und im Rahmen des Projekts identifizierten Modulatoren von Kinasen und Phosphatasen zur Effizienzmaximierung und Toxizitätsminimierung für zielgerichtete Therapien optimiert. Diese Optimierung soll zum einen durch neuartige zielgerichtete Therapiestrategien, wie Antibody Drug Conjugates und Identifizierung Gewebe-spezifischer Kinasen/Phosphatase-aktivitätsmodulierender Substanzen, zum anderen durch neuartige Kombinationstherapien von z.B. verschiedenen Kinase-Inhibitoren, Kinase-Inhibitoren plus weitere pharmakologische Zielstrukturen (G-Protein-gekoppelte Rezeptoren, immunmodulatorische Moleküle, etc.) oder auch Kinase- plus Phosphatase-Modulatoren erreicht werden. Hierbei kommt die fachübergreifende Expertise besonders zum Tragen, da toxische Wirkungen oft in Nicht-Zielgeweben auftreten.
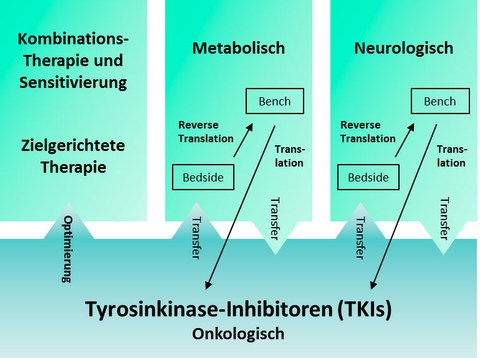
III. Onkologische Kombinationstherapie mit TKIs und reverse Translation von TKIs in neue Therapiebereiche
Mit den TKIs ist eine Klasse von phosphorylierungsmodifizierenden Medikamenten mit großem Erfolg in die onkologische Therapie eingeführt worden. Im EKFK werden TKIs zum einen im Bereich der Hämatologie/Onkologie in Kombination mit Chemo- und /oder Radiotherapie untersuchen, um bestehende Therapieschemata zu optimieren und die Indikationen innerhalb der Onkologie auszuweiten. Um die TKIs auch jenseits von Hämatologie/Onkologie zu implementieren, werden Patienten mit neurologischen und metabolischen Erkrankungen, die aus onkologischer Indikation mit TKIs therapiert werden, konsequent auf die Beeinflussung dieser Erkrankungen hin untersucht. Anschließend werden TKIs im Zellmodell systematisch hinsichtlich ihrer Fähigkeit untersucht, die für diese neue Indikation grundlegenden Krankheitsmechanismen zu korrigieren, um dann über Klein- und Großtiermodelle das therapeutische Potential zu validieren. Im Idealfall schließt sich eine Phase I - Studie am Menschen an. Der Clinician Scientist kann so sowohl von Bench-to-Bedside als auch von Bedside-to-Bench neuartige Therapieoptionen direkt erproben.