11.09.2023
Dresdner Forschende entwickeln Landkarte zur Erforschung junger Bauspeicheldrüsenzellen
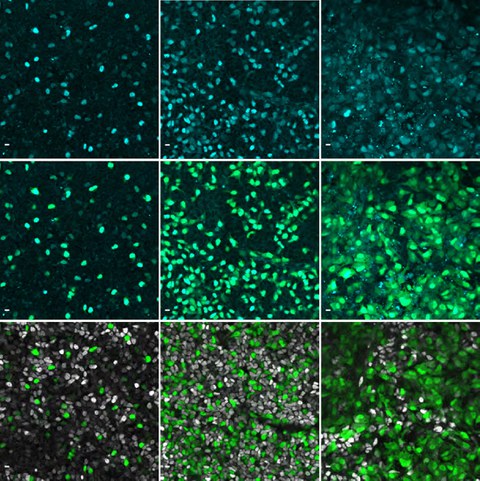
Immunofluoreszenzbilder zeigen das Gen NEUROG3 in Cyan in menschlichen Zellen der Bauchspeicheldrüse.
Die Bauchspeicheldrüse besteht aus verschiedenen Zellen, die bei der Kontrolle unseres Blutzuckers sehr wichtig sind. Fallen in diesen Zellen bestimmte Gene beispielsweise aufgrund einer Mutation aus, kann dies zur Entwicklung von Diabetes führen. Eines dieser Gene in den Pankreaszellen ist Neurogenin 3 (NEUROG3). Dieses Gen ist während der Entwicklung der Bauchspeicheldrüse nur für kurze Zeit aktiv, spielt aber bei der Differenzierung der endokrinen Zelltypen der Langerhans-Inseln aus den epithelialen Vorläuferzellen eine Schlüsselrolle. Forschende aus Dresden und der Novo Nordisk Foundation an der Universität Kopenhagen haben nun eine spezielle Methode verwendet, um sowohl die Aktivität des Gens als auch das Protein, das es in menschlichen Bauchspeicheldrüsenzellen bildet, zu beobachten und damit das Gen besser zu verstehen. Die Ergebnisse der Studie wurden jetzt in renommierten Fachjournal „Developmental Cell“ veröffentlicht.
Unterschiedliche Zellen in der Bauchspeicheldrüse kontrollieren unseren Blutzuckerspiegel, beispielsweise die Insulin produzierenden Betazellen oder die Glukagon bildenden Alphazellen. Insulin hilft, unseren Blutzuckerspiegel zu senken, während Glukagon das Gegenteil bewirkt und den Blutzuckerspiegel erhöht. Wenn diese Zellen nicht mehr funktionieren oder absterben, erkranken wir an Diabetes. Während unseres Körperwachstums stammen alle diese speziellen Zellen von einem einzigen Zelltyp in der Bauchspeicheldrüse ab, den endokrinen Vorläuferzellen des Pankreas. Dieser Zelltyp nutzt nur für kurze Zeit das Gen NEUROG3, um seine Aufgabe zu erfüllen.
Das Team von Anne Grapin-Botton, geschäftsführende Direktorin am Max-Planck-Instituts für molekulare Zellbiologie und Genetik (MPI-CBG) und Forschungsgruppenleiterin am Paul-Langerhans-Institut Dresden, hat sich zusammen mit Kollegen der Novo Nordisk Foundation an der Universität Kopenhagen zum Ziel gesetzt, diese NEUROG3 exprimierenden Vorläuferzellen in der Bauchspeicheldrüse genauer zu erforschen und zu verstehen, wie sich dieses Gen in einzelnen Zellen verhält. “Wir haben spezielle Marker verwendet, um NEUROG3 in diesen Zellen zu lokalisieren. Das hat es uns ermöglicht in Live-Aufnahmen zu beobachten, wie sich die Zellen über einen längeren Zeitraum bewegen“, erklärt Belin Selcen Beydag-Tasöz, die Erstautorin der Studie, und fährt fort: „Indem wir 2D- und 3D-Modelle der menschlichen Bauchspeicheldrüse betrachteten, fanden wir heraus, dass die Expression des NEUROG3-Gens in den verschiedenen Zellen unterschiedlich war. Einige Zellen exprimierten das Gen stark, andere nur schwach. Überraschenderweise bildeten alle Zellen, in denen NEUROG3 nachweisbar war, trotz dieser Unterschiede Zellen, die Hormone produzieren. Ein anderes überraschendes Ergebnis der Studie war, dass NEUROG3 bei Menschen etwa zweimal langsamer arbeitet als bei Mäusen. Das bedeutet, dass dieses Gen bei Menschen mehr Zeit braucht, um seine Aufgabe zu erfüllen als bei Mäusen.“
Das Team nutzte eine Langzeit-Live-Bildgebungsmethode, um einen Prozess zu beobachten, der normalerweise im Mutterleib verborgen bleibt. Dies ermöglichte es, das dynamische Verhalten von Bauchspeicheldrüsenzellen, welches in Live-Aufnahmen beobachtet werden konnte, mit allen von ihnen produzierten Genen zu verknüpfen. Dadurch lässt sich besser verstehen, wie sich die hormonproduzierenden Zellen der Bauchspeicheldrüse entwickeln. Insbesondere die Helligkeit der Zellen half ihnen dabei, die Aktivität der Gene mit dem Verhalten der Zellen zu kombinieren. Auf diese Weise konnte das Forschungsteam auch zeigen, dass ein anderes Gen namens KLK12 dafür sorgt, dass die Zellen sich bewegen, um Langerhans-Inseln zu bilden, sobald das NEUROG3-Gen zu arbeiten beginnt.
Anne Grapin-Botton, die die Studie leitete, fasst zusammen: „Die Zellkultursysteme, die wir entwickelt haben, um zu verstehen, wie Zellen in menschlichen Embryonen Organe bilden, tragen erste Früchte. In unserer Studie haben wir wesentlich mehr über die Art und Weise gelernt, wie die Aktivität bestimmter Gene während der embryonalen Entwicklung zu Diabetes im späteren Leben führen kann. Diese Ergebnisse können jetzt dazu beitragen, den Weg dafür zu ebnen, dass mehr dieser Zellen für therapeutische Zwecke gewonnen werden könnten, beispielsweise für die Produktion und Transplantation dieser Zellen in Patienten, die an Diabetes leiden.
Original Publikation
Belin Selcen Beydag-Tasöz, Joyson Verner D’Costa, Lena Hersemann, Byung Ho Lee, Federica Luppino, Yung Hae Kim, Christoph Zechner, Anne Grapin-Botton: Integrating single-cell imaging and RNA sequencing datasets links differentiation and morphogenetic dynamics of human pancreatic endocrine progenitors, Developmental Cell, 2023, https://doi.org/10.1016/j.devcel.2023.07.019.
