Schwerpunkt der Forschungsarbeit
Entscheidungen über das Zellschicksal von Vorläufer- und Stammzellen des Pankreas
Wir wollen verstehen, wie extrazelluläre Signale und intrinsische genetische Programme zusammenwirken, um das Zellschicksal von Stamm- und Vorläuferzellen zu bestimmen und schließlich ausgereifte Phänotypen zu entwickeln. Unser Hauptaugenmerk liegt auf der Entwicklung der endokrinen Linie in der Bauchspeicheldrüse und der Umwandlung menschlicher pluripotenter Stammzellen in funktionale Betazellen. Die Schlüsselfragen, mit denen wir uns befassen, betreffen zum einen die Signale, die die Zellübergänge während der Pankreasdifferenzierung steuern, und zum anderen die Regulatoren der zeitlichen Abläufe dieser Prozesse.
Wir haben ein neues Signal, mit Namen Sphingosin-1-Phosphat, identifiziert, welches eine konservierte Rolle bei der Aggregation von endokrinen Zellen zur Bildung von pankreatischen Inseln spielt. Derselbe Signalweg vermittelt das Überleben von azinären und endokrinen Vorläuferzellen und löst deren Differenzierung durch die Stabilisierung von YAP und die Abschwächung der Notch-Signalisierung aus. Darüber hinaus haben wir festgestellt, dass Effektoren der GPCR-Signalübertragung die Abstammungszuordnung während der Pankreasentwicklung regulieren.
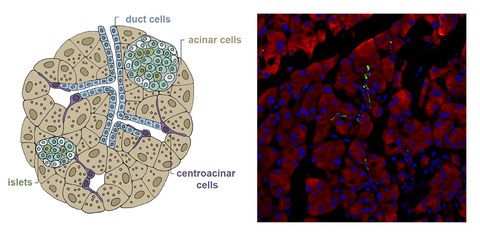
Darüber hinaus haben wir festgestellt, dass Aldh1b1, ein Gen, das für ein mitochondriales Enzym kodiert, den Zeitpunkt der Differenzierung im sich entwickelnden Pankreas reguliert. Das Gen wird in allen Vorläuferzellen des Pankreas während der Entwicklung und in wenigen zentroazinären Zellen des adulten Pankreas exprimiert, nicht aber in ausdifferenzierten Pankreaszellen. Die Deaktivierung von Aldh1b1 während der Entwicklung beschleunigt die Differenzierung und beeinträchtigt die Funktionalität der adulten Betazellen. Jüngste Erkenntnisse deuten darauf hin, dass Aldh1b1 ein Stoffwechselregulator ist, der die Erreichbarkeit von Chromatin in den Vorläuferzellen mitbestimmt. Genetische Abstammungsanalysen zeigten, dass die wenigen Aldh1b1-exprimierenden Zellen in der adulten Bauchspeicheldrüse Zellen aller drei pankreatischen Abstammungslinien hervorbringen und dass Aldh1b1 für die Entwicklung von Bauchspeicheldrüsenkrebs erforderlich ist.
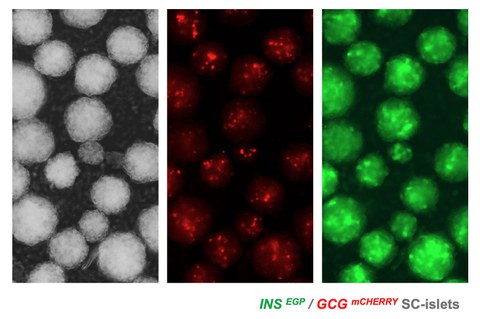
Wir nutzen diese Erkenntnisse, um von hPS-Zellen abgeleitete Vorläuferzellen der Bauchspeicheldrüse zu expandieren und sie effizient in Pankreasinseln mit reifen Betazellen (SC-Inseln) umzuwandeln. Um den Prozess der Identifizierung optimaler Bedingungen zu beschleunigen, haben wir eine Reihe von hPS-Zellreporterlinien und eine automatisierte Bildgebungspipeline entwickelt. Außerdem beziehen wir Endothelzellen und Perizyten in die Differenzierung von SC-Inseln ein, um die Reifung zu beschleunigen und ihre Integration nach der Transplantation zu verbessern. Weitere aktuelle Arbeiten deuten darauf hin, dass Aldh1b1-exprimierende zentroazinäre Zellen tumorauslösende Zellen sein könnten, und wir untersuchen diese Beobachtungen, um die frühen Stadien der Krankheitsentwicklung besser zu verstehen.
Zukünftige Projekte und Ziele
- Identifizierung der Signalanforderungen und der zugrunde liegenden molekularen Mechanismen für die verschiedenen Pankreaslinien
- Aufklärung der Rolle des Stoffwechsels bei der Differenzierung von Vorläuferzellen der Bauchspeicheldrüse und der Betazellfunktionalität
- Erforschung der Rolle der Vorläuferzellen des adulten Pankreas bei der Krebsentstehung
- Nutzung gezielter Differenzierungsmethoden menschlicher pluripotenter Stammzellen in Pankreasinseln, um die menschliche endokrine Entwicklung besser zu verstehen und Zelltherapien für Diabetes weiterzuentwickeln