3 D Metallaerogele
Als Aerogele werden makroskopische, hochporöse Festkörper beschrieben, welche aus einem nanostrukturiertem schwammartigen Netzwerk bestehen, dessen Poren mit Luft gefüllt sind. Ihre hohe Porosität (bis über 95 %), extrem geringe Dichte (bis zu 0,0011 g/cm-3) und offenporige Struktur (Porendurchmesser von <1 bis weit über 100 nm) machen sie zu einer einzigartigen Materialklasse.

Abb.1
Abb. 1: Ein Metallaerogel auf unterschiedlichen Ebenen: Metallaerogele bilden meist schwarze Festkörper (links) aus, welche eine schwammartige Gelstruktur aufweisen (mitte-links). Das Gel selbst besteht aus Strängen (mitte-rechts), welche aus aggregierten Nanopartikeln aufgebaut sind. Mit Hilfe von energiedispersiver Röntgenspektroskopie, gekoppelt mit Rastertransmissionselektronenmikroskopie kann die Elementverteilung in den Gelsträngen sichtbar gemacht werden (rechts).
Üblicherweise werden Aerogele über einen dem Sol-Gel-Prozess ähnlichen Verfahren hergestellt, wobei das netzwerkdurchdringende Lösungsmittel am Ende der Herstellung schonend per Gefriertrocknung oder überkritischer Trocknung entfernt wird. Dies minimiert das Auftreten von Kapillarkräften, welche die fragile Struktur beschädigen oder verformen könnten. Die Übertragung dieses Prinzips in die Nanotechnologie unter Verwendung von kolloidalen Metallnanopartikeln als Bausteine für das Gelnetzwerk gelang unserer Gruppe weltweit erstmalig 2009. Damit wurde eine einfache Möglichkeit etabliert, oxidfreie, rein metallische Aerogele aus Edelmetallen (z.B. Au, Ag, Pt und Pd), sowie deren Mischungen (z.B. AuPt, AuAg und PdPt), herzustellen. Später konnte die Methode auch auf unedlere Metalle (z.B. Co, Ni und Cu) erweitert werden.
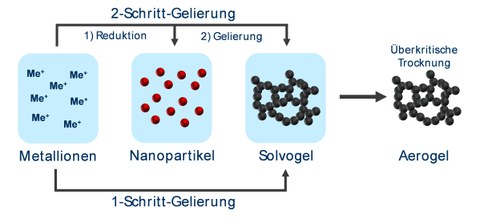
Abb.2
Abb. 2: Schema zur Synthese von Metallaerogelen. Diese kann in die Teilschritte der Nanopartikelherstellung und –gelierung untergliedert werden. Beide Schritte können separat (2-Schritt-Gelierung) oder gleichzeitig (1-Schritt-Gelierung) durchgeführt werden. Abschließend muss das Gel speziell getrocknet werden, um es ins Aerogel zu überführen.
Um die Gelierung der Nanopartikel zu initiieren bedarf es meist einer kontrollierten Destabilisierung, beispielsweise durch die Änderung der Polarität des Lösungsmittels, Elektrolytzusatz oder durch eine (oxidative) Entfernung der stabilisierenden Nanopartikelliganden. Mittlerweile wurde eine Vielzahl von Möglichkeiten entwickelt, um diesen Vorgang möglichst einfach und schnell zu realisieren. Dazu zählen ligandenfreie Herstellungsverfahren, die Gefriergelierung oder die Gelierung in verschiedenen Lösungsmitteln, wie Wasser und Ethanol. Letztendlich bilden sich ungeordnete, komplexe, hochporöse Überstrukturen mit erstaunlich großen inneren Oberflächen. Obwohl die Gelkörper bis zu mehrere Millimeter große Monolithe ausbilden können, spiegeln sie dennoch viele der außergewöhnlichen Eigenschaften der sie erzeugenden Nanoobjekte wider.
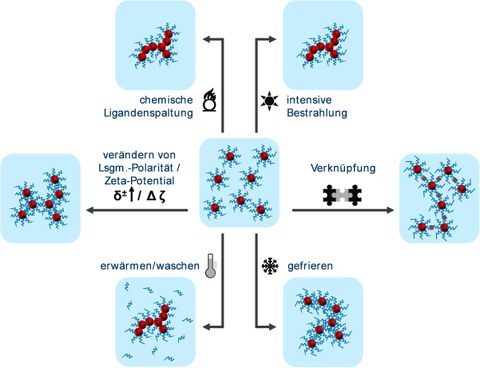
Abb.3
Abb. 3: Unterschiedliche Methoden zur Destabilisierung von kolloidalen Metallnanopartikeln zur Initiierung der Gelierung.
Die Kombination aus dieser offenporigen, hochporösen und selbsttragenden Gelstruktur, sowie einer exzellenten elektrischen Leitfähigkeit und hohen katalytischen Aktivität machen Metallaerogele zu idealen Kandidaten einer neuen Klasse an Elektrokatalysatoren. Dieses Potential wurde in unserer Gruppe erkannt und erstmals in der Elektrooxidation von Ethanol (EOR) bestätigt. Der Einsatz von Cyclodextrin-modifizierten Pd-Aerogelen konnte die Stromdichte der EOR im Vergleich zum kommerziellen Katalysator (Pd/C) verdoppeln. Neben der Herstellung und dem Einsatz von bimetallischen Aerogelen, stellt auch die Modifikation der Morphologie der Gelnetzwerke einen zentralen Punkt unserer Arbeit dar. Dafür wird unter anderem der galvanische Austausch genutzt, um beispielsweise poröse Pd- und PtNi-Hohlschalen zu erzeugen und diese in Gelstrukturen zu überführen. Deren Einsatz in der Sauerstoffreduktion (ORR) führte zu einer 18-fachen höheren massenbezogenen Aktivität im Vergleich zum kohlenstoffgeträgerten Standardkatalysator. Im Zuge der Energiewende liegt unser Fokus ebenfalls auf der Implementierung von Aerogele in Brennstoffzellen. Dafür hergestellte PtNi-Aerogele konnten wir mit unseren Kooperationspartnern vom Paul-Scherrer-Institut (Schweiz) in eine 1 cm2 große Elektrode integrieren und in einem Prototyp einer Brennstoffzelle testen. Der Aerogelkatalysator zeigte eine dreifach höhere katalytische Aktivität als der Pt/C-Katalysator.
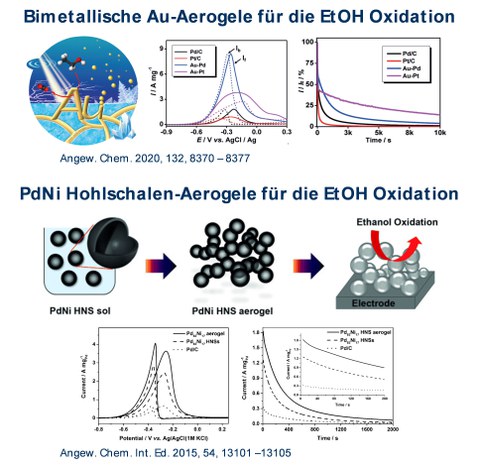
Abb.4
Abb. 4: Beispiele für die Anwendung von Metallaerogelen in der elektrokatalytischen Oxidation von EtOH. Die Metallaerogele zeigen höhere Aktivitäten und verbesserte Langzeitstabilitäten im Vergleich zum kohlenstoffgeträgerten Standardkatalysator.
Abb.5
Abb. 5: Weitere Forschungsfelder der Arbeitsgruppe Eychmüller auf dem Gebiet der Metallaerogele.
Empfehlenswerte Literatur:
(1) Ziegler, C.; Wolf, A.; Liu, W.; Herrmann, A. K.; Gaponik, N.; Eychmüller, A. Modern Inorganic Aerogels. Angew. Chemie - Int. Ed. 2017, 56 (43), 13200–13221. https://doi.org/10.1002/anie.201611552.
(2) Bigall, N. C.; Herrmann, A. K.; Vogel, M.; Rose, M.; Simon, P.; Carrillo-Cabrera, W.; Dorfs, D.; Kaskel, S.; Gaponik, N.; Eychmüller, A. Hydrogels and Aerogels from Noble Metal Nanoparticles. Angew. Chemie - Int. Ed. 2009, 48 (51), 9731–9734. https://doi.org/10.1002/anie.200902543.
(3) Liu, W.; Herrmann, A. K.; Geiger, D.; Borchardt, L.; Simon, F.; Kaskel, S.; Gaponik, N.; Eychmüller, A. High-Performance Electrocatalysis on Palladium Aerogels. Angew. Chemie - Int. Ed. 2012, 51 (23), 5743–5747. https://doi.org/10.1002/anie.201108575.
(4) Cai, B.; Wen, D.; Liu, W.; Herrmann, A. K.; Benad, A.; Eychmüller, A. Function-Led Design of Aerogels: Self-Assembly of Alloyed PdNi Hollow Nanospheres for Efficient Electrocatalysis. Angew. Chemie - Int. Ed. 2015, 54 (44), 13101–13105. https://doi.org/10.1002/anie.201505307.
(5) Henning, S.; Ishikawa, H.; Kühn, L.; Herranz, J.; Müller, E.; Eychmüller, A.; Schmidt, T. J. Unsupported Pt-Ni Aerogels with Enhanced High Current Performance and Durability in Fuel Cell Cathodes. Angew. Chemie - Int. Ed. 2017, 56 (36), 10707–10710. https://doi.org/10.1002/anie.201704253.
(6) Du, R.; Wang, J.; Wang, Y.; Hübner, R.; Fan, X.; Senkovska, I.; Hu, Y.; Kaskel, S.; Eychmüller, A. Unveiling Reductant Chemistry in Fabricating Noble Metal Aerogels for Superior Oxygen Evolution and Ethanol Oxidation. Nat. Commun. 2020, 11 (1), 1–10. https://doi.org/10.1038/s41467-020-15391-w.
