Spektroskopie und Elektrochemie
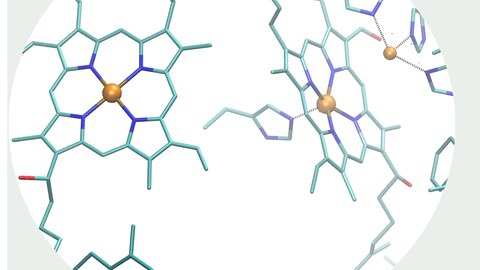
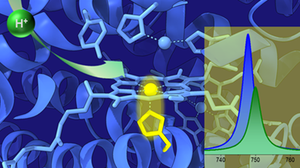
Unser Forschungsinteresse gilt dem Verständnis und der Optimierung photo-elektrokatalytischer Energieumwandlungs-Reaktionen. Um universelle Prinzipien bei der Aktivierung von Sauerstoff, Wasserstoff oder Kohlendioxid zu identifizieren, untersuchen wir enzymatische, molekulare und materialbasierte Systeme. In unserem Forschungsansatz kombinieren wir ...
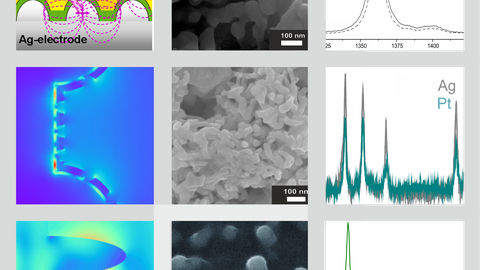
 © I. Weidinger
© I. Weidinger
Spektroskopie und Elektrochemie
Unser Forschungsinteresse gilt dem Verständnis und der Optimierung photo-elektrokatalytischer Energieumwandlungs-Reaktionen. Um universelle Prinzipien bei der Aktivierung von Sauerstoff, Wasserstoff oder Kohlendioxid zu identifizieren, untersuchen wir enzymatische, molekulare und materialbasierte Systeme. In unserem Forschungsansatz kombinieren wir elektrochemische Techniken mit Schwingungsspektroskopie, die funktionelle, strukturelle und oft komplementäre Informationen über das interessierende System liefert. Diese Forschungsthemen werden im Rahmen des SFB 1415 "Chemie 2-dimensionaler Materialien" und des Exzellenzclusters "UniSysCat" untersucht.
Ein weiteres Forschungsinteresse besteht darin, Elektrodensysteme für die oberflächenverstärkte Raman- und IR-Spektro-Elektrochemie weiterzuentwickeln. Hier beschäftigen wir uns mit neuen Materialien und Morphologien sowie dem Einfluss der Lichtverstärkung auf die Photokatalyse.
Weitere Informationen finden Sie in K. Ly, Chem. Commun. 2021 und P. Kielb, GIT Laboratory Journal 2016.