23.02.2021
Cre-Controlled CRISPR: konditionale Gen-Inaktivierung wird einfacher
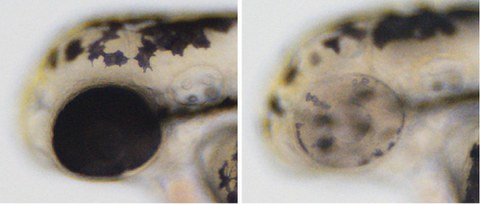
Cre-Controlled CRISPR in Aktion. Links: wildtypischer Kontrollembryo mit schwarzen Pigmenten in Melanozyten entlang des Körpers und in Zellen des Auges. Rechts: gewebespezifische Inaktivierung führt zum Verlust der Pigmentierung im Auge aber nicht in den Melanozyten entlang des Körpers.
Die Fähigkeit, ein Gen nur in einem bestimmten Zelltyp auszuschalten, ist für die modernen Lebenswissenschaften wesentlich. Dank des Cre-Controlled CRISPR ist es jetzt noch einfacher geworden. Die neue Methode, die von Forschern des Zentrums für Regenerative Therapien Dresden (CRTD) an der TU Dresden mit Unterstützung des DRESDEN-concept Genome Center (DCGC) entwickelt wurde, bietet einen schnellen und einfachen Ansatz zur konditionalen Gen-Inaktivierung. Die Ergebnisse wurden im Fachjournal „Nature Communications" veröffentlicht.
Um die Funktion eines Gens zu entdecken, schalten Forscher es aus und beobachten die Folgen. Oft haben Gene jedoch mehrere Funktionen, die sich je nach Gewebe und Alter unterscheiden. Einige Gene sind essentiell für das Wachstum; schaltet man sie zu früh aus, kann das tiefgreifende Folgen haben, die die Beobachtung anderer Funktionen unmöglich machen. Um dies zu vermeiden, verwenden Forscher die konditionale Gen-Inaktivierung, die es erlaubt, ein Gen nur in einem bestimmten Gewebe oder zu einem bestimmten Zeitpunkt in der Entwicklung, z.B. im Erwachsenenalter, abzuschalten.
Eines der Systeme, die für die konditionale Gen-Inaktivierung verwendet werden, ist Cre/lox. „Es ist der Goldstandard für die konditionale Geninaktivierung in Mäusen, hat aber im Laufe der Zeit auch in anderen Modellorganismen wie dem Zebrafisch eine große Bedeutung erlangt", sagt Dr. Stefan Hans, Forscher am CRTD und Autor der Studie. Das Cre/lox-System basiert auf einem Enzym, der so genannten Cre-Rekombinase, und speziellen Sequenzen, den so genannten lox. Die lox-Sequenzen werden in das Genom um das betreffende Gen herum eingefügt. Cre erkennt die lox-Sequenzen und entfernt das dazwischenliegende Gen. Auf diese Weise wird das Gen ausgeschaltet. Im Laufe der Jahre hat die Forschungsgemeinschaft viele Tierlinien entwickelt, bei denen die Cre-Rekombinase nur in einem bestimmten Gewebe vorhanden ist. Mit solchen Cre-Linien ist es möglich, ein Gen nur in einem Gewebe auszuschalten, nicht aber in den anderen.
Das Flankieren eines Gens mit lox-Sequenzen ist weit verbreitet, hat aber auch Nachteile. „Die Inaktivierung eines bestimmten Gens ist sehr zeit- und arbeitsaufwändig. Es erfordert anspruchsvolle Genomveränderungen und nimmt mehrere Tiergenerationen in Anspruch, bis das eigentliche Experiment angegangen werden kann", erklärt Dr. Hans. „Im Vergleich zu der Methode, die wir etabliert haben, ist das langsam und sehr mühsam", fügt er hinzu.
Cre-Controlled CRISPR, die neue Methode, die von einem Dresdner Forscherteam um Prof. Michael Brand entwickelt wurde, kombiniert die Vorteile des Cre/lox-Systems mit der Genschere CRISPR/Cas9. Das CRISPR/Cas9-System ist eine relativ neue Methode, die in kurzer Zeit die Lebenswissenschaften revolutionierte. Die beiden Entdeckerinnen von CRISPR/Cas9 wurden 2020 mit dem Nobelpreis für Chemie ausgezeichnet. Obwohl CRISPR/Cas9 generell einfach anzuwenden ist, lässt es sich nicht ohne Weiteres auf ein bestimmtes Gewebe beschränken.
„Bei Cre-Controlled CRISPR nutzen wir die gewebespezifische Expression von Cre und die Einfachheit der Gen-Editierung von CRISPR/Cas9", sagt Dr. Hans. „Durch die Verbindung der beiden Methoden haben wir eine Version von CRISPR/Cas9 geschaffen, die durch eine Cre-Rekombinase angeschaltet wird. Mit unserer Methode können die Forscher immer noch auf riesige Sammlungen von schon etablierten Tierlinien zurückgreifen, die Cre in verschiedenen Geweben exprimieren. Aber Cre-Controlled CRISPR nimmt die mühsame Genom-Editierung weg, weil es die Notwendigkeit beseitigt, ein Gen mit lox-Sequenzen zu flankieren. Es erfordert eigentlich nur eine Sequenz, die in das Genom eingefügt wird, unabhängig davon, welches das gewünschte Gen ist", erklärt Dr. Hans. Ohne die Notwendigkeit, ein Gen zwischen die lox-Sequenzen zu klemmen, ist Cre-Controlled CRISPR schneller und einfacher.
Doch Cre-Controlled CRISPR ist nicht nur einfacher zu etablieren, sondern bietet wie CRISPR/Cas9 auch die Möglichkeit, mehrere Gene auf einmal auszuschalten. Darüber hinaus haben die CRTD-Forscher ihre Methode so gestaltet, dass sie spätere Analysen an den Zellen, in denen Cre-Controlled CRISPR eingesetzt wurde, erleichtert. Sobald CRISPR/Cas9 eingeschaltet ist, werden die Zellen mit einem grün fluoreszierenden Protein (GFP) markiert. Fluoreszierende Proteine wie GFP werden häufig in den Lebenswissenschaften eingesetzt und bieten unzählige Möglichkeiten, die markierten Zellen von anderen zu trennen, um sie für weitere Experimente wie z.B. Next Generation Sequencing zu verwenden.
„Obwohl wir Cre-Controlled CRISPR als Proof-of-Concept im Zebrafisch entwickelt haben, ist die Methode vielseitig verwendbar und sollte auch in andere Modellorganismen anwendbar sein", ergänzt Dr. Hans.
Originalveröffentlichung
Stefan Hans, Daniela Zöller, Juliane Hammer, Johanna Stucke, Sandra Spieß, Gokul Kesavan, Volker Kroehne, Juan Sebastian Eguiguren, Diana Ezhkova, Andreas Petzold, Andreas Dahl and Michael Brand: Cre-Controlled CRISPR mutagenesis provides fast and easy conditional gene inactivation in zebrafish. Nature Communications (February 2021) https://doi.org/10.1038/s41467-021-21427-6
Über das Zentrum für Regenerative Therapien Dresden (CRTD)
Am Zentrum für Regenerative Therapien Dresden (CRTD) der TU Dresden widmen sich Spitzenforscher aus mehr als 30 Ländern neuen Therapieansätzen. Sie entschlüsseln die Prinzipien der Zell- und Geweberegeneration und ergründen deren Nutzung für Diagnose, Behandlung und Heilung von Krankheiten. Das CRTD verknüpft Labor und Klinik, vernetzt Wissenschaftler mit Ärzten, nutzt Fachwissen in Stammzellforschung, Entwicklungsbiologie, Genom-Editing und Geweberegeneration, um letztlich die Heilung von Erkrankungen wie Alzheimer und Parkinson, hämatologischen Krankheiten wie Leukämie, Stoffwechselerkrankungen wie Diabetes sowie Augen- und Knochenerkrankungen zu erreichen.
Seit 2016 ist das CRTD eines von drei Instituten der zentralen wissenschaftlichen Einrichtung Center for Molecular and Cellular Bioengineering (CMCB) der TU Dresden. Es trägt entscheidend zur Profilierung der TU Dresden im Bereich Gesundheitswissenschaften, Biomedizin und Bioengineering bei.
www.tu-dresden.de/cmcb/crtd
www.tu-dresden.de/cmcb
Über das DRESDEN-concept Genome Center (DcGC)
Das DcGC ist ein gemeinsames Sequenzierungszentrum der Core Facility Hochdurchsatzsequenzierung am Center for Molecular and Cellular Bioengineering (CMCB) der TU Dresden und der Sequencing Facility des Max-Planck-Instituts für molekulare Zellbiologie und Genetik (MPI-CBG). Es ist eines von vier DFG-geförderten deutschen Kompetenzzentren für das Next Generation Sequencing. Das DcGC ist ein Zusammenschluss von Mitarbeitern des CMCB, des MPI-CBG, sowie des Zentrums für Systembiologie Dresden (CSBD). Das DcGC besteht aus drei Plattformen, die sich auf long-read-Sequenzierungstechnologien, Einzelzell-Sequenzierung und short-read-Sequenzierung konzentrieren, und deckt die experimentellen Workflows und die bioinformatische Analyse ab.
Informationen für Journalisten:
Prof. Michael Brand
Tel.: +49 351 458-82300
