12.01.2024
Unheilbare Autoimmunerkrankung SLE: Neue genetische Erkenntnisse eröffnen Perspektiven für zukünftige Therapieansätze

Prof. Dr. med. Min Ae Lee-Kirsch
Der systemische Lupus erythematodes (SLE) ist eine Autoimmunerkrankung, bei der das Immunsystem, das normalerweise den Körper vor Infektionen schützt, sich gegen die eigenen Zellen richtet. Diese komplexe Erkrankung kann jedes Organ betreffen und manifestiert sich häufig in Hautausschlägen, Arthritis, Blutgerinnseln, Nephritis, Herzerkrankungen, Fatigue und psychiatrischen Problemen. Aktuelle Behandlungsansätze zielen darauf ab, die Krankheitsaktivität mit immunsuppressiven Medikamenten zu unterdrücken, was jedoch mit erheblichen Nebenwirkungen verbunden sein kann.
Forschungseinblick: Genetische Ursache für SLE unter der Lupe
Eine Forschergruppe unter der Leitung von Min Ae Lee-Kirsch von der Klinik für Kinder- und Jugendmedizin, Medizinische Fakultät der Technischen Universität Dresden, hat sich intensiv mit SLE befasst. Die Untersuchungen konzentrierten sich auf vier Patienten aus zwei Familien, bei denen sich SLE bereits in den ersten Lebensjahren entwickelte. Die ungewöhnliche Familiengeschichte lenkte die Aufmerksamkeit auf eine mögliche genetische Ursache, die das Team schließlich im UNC93B1-Gen identifizierte.
UNC93B1: Ein Schlüsselprotein mit weitreichenden Auswirkungen
UNC93B1 ist ein membrangebundenes Strukturprotein, das für die Reifung und den intrazellulären Transport von Rezeptoren verantwortlich ist, die eine entscheidende Rolle bei der Abwehr von Virusinfektionen spielen. Genauer gesagt, erkennen diese Rezeptoren die Nukleinsäure-Komponente des Virus, was zur Aktivierung von antiviral wirkenden Typ 1-Interferonen führt. Nukleinsäuren, wie DNA und RNA, kommen jedoch nicht nur in Viren vor, sondern sind auch in jeder Zelle des menschlichen Körpers vorhanden. Dies bedeutet, dass das Immunsystem in der Lage sein muss, fremde von körpereigenen Nukleinsäuren zu unterscheiden. Die entdeckten UNC93B1-Mutationen führen zu einer selektiven Überaktivierung von TLR7, einem von UNC93B1 regulierten Rezeptor, der spezifisch RNA erkennt. Diese Überaktivierung löst eine fehlerhafte Erkennung körpereigener RNA aus, was zu unkontrollierter Überproduktion von Typ 1-Interferon und entzündlichen Prozessen führt. Dies begünstigt zudem das Überleben selbstreaktiver B-Zellen, die Autoantikörper produzieren und so die autoimmune Reaktion verstärken.
Klinische Relevanz und mögliche Therapieansätze
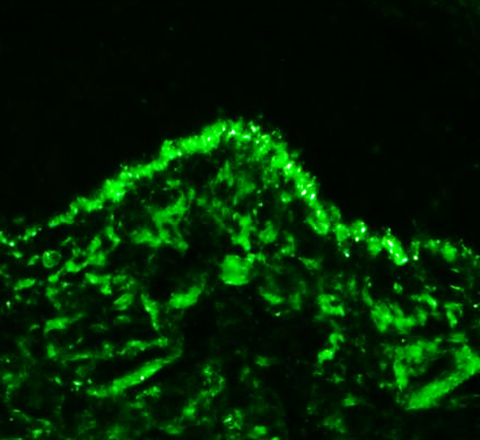
Ablagerungen von Immunkomplexen (grün) in der Haut eines Lupuspatienten
Die Ergebnisse dieser Studie haben nicht nur grundlegende Bedeutung, sondern zeigen auch vielversprechende Ansätze für die Entwicklung neuer Therapien. Menschen mit fehlendem funktionellem UNC93B1 sind anfällig für schwerwiegende Virusinfektionen, was die entscheidende Rolle von UNC93B1 für ein gesundes Immunsystem unterstreicht. Frau Prof. Lee-Kirsch betont die klinische Relevanz und sieht Potenzial für die Entwicklung zielgerichteter Therapieansätze: "Unsere Studie zeigt einen direkten Zusammenhang zwischen einer überaktiven UNC93B1/TLR7-Achse und der Lupus-Pathogenese. Eine medikamentöse Blockade von überaktivem TLR7 könnte daher therapeutisch wirksam sein. Diese Erkenntnisse dürften daher die Entwicklung von TLR7-Inhibitoren für Patienten mit SLE und verwandten Autoimmunerkrankungen beschleunigen."
Die Dekanin der Medizinischen Fakultät, Prof. Dr. med. Dr. Esther Troost betont: "Die Forschung, die an unserer medizinischen Fakultät durchgeführt wird, strebt danach, das Verständnis von Krankheiten zu vertiefen und innovative Lösungen für die Gesundheitsversorgung zu finden. Unsere engagierten Wissenschaftler setzen sich leidenschaftlich für medizinischen Fortschritt ein, um das Wohl der Patienten weltweit zu verbessern." Prof. Dr. Michael Albrecht, Medizinischer Vorstand des Universitätsklinikum Dresden: „Die Ergebnisse dieser Studie haben nicht nur grundlegende Bedeutung, sondern zeigen auch vielversprechende Ansätze für die Entwicklung neuer Therapien für Menschen mit Autoimmunerkrankungen.“
Die Studie wurde zum Teil von der Deutschen Forschungsgemeinschaft (DFG) und dem Bundesministerium für Bildung und Forschung (BMBF) finanziert.
Die Ergebnisse wurden am 11. Januar 2024 in Science Immunology als Early Release veröffentlicht. https://www.science.org/doi/10.1126/sciimmunol.adi9769
Titel der Publikation: UNC93B1 variants underlie TLR7-dependent autoimmunity, Wolf et al.
Kontakt
Prof. Dr. med. Min Ae Lee-Kirsch
Klinik für Kinder- und Jugendmedizin
Medizinische Fakultät Carl Gustav Carus
Technische Universität Dresden
Fetscherstr. 74, 01307 Dresden
Telefon: +49 (0) 351 458-16878
