26.08.2024
Ein Blick in die Zukunft: Zebrafische können ihre Photorezeptoren wieder vollständig funktional regenerieren
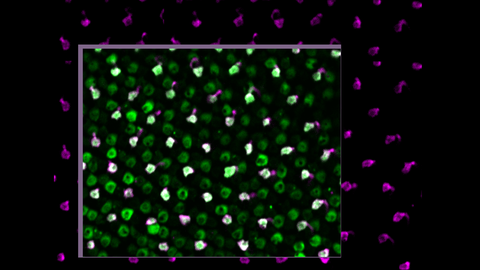
Zebrafisch-Photorezeptorzellen, stimuliert mit blauem Licht, zeigen korrekte elektrische Aktivität. Das Bild wurde mit einem speziell für diese Studie entwickelten Mikroskop aufgenommen.
Bei vielen Formen von Blindheit sind die lichtempfindlichen Sehzellen im Auge – die Photorezeptoren - geschädigt. Diese Zellen können vom menschlichen Körper nicht regeneriert werden. Während Forschende an neuen Methoden zum Ersatz dieser Zellen arbeiten, stellt sich die entscheidende Frage, ob solche regenerierten Photorezeptoren das Sehvermögen vollständig wiederherstellen können. Nun hat ein Forschungsteam unter Leitung von Prof. Michael Brand am Zentrum für Regenerative Therapien Dresden (CRTD) der Technischen Universität Dresden einen wichtigen Fortschritt erzielt. Zebrafische können ihre Photorezeptoren von Natur aus erneuern, und nun konnte das Team zeigen, dass diese regenerierten Sehzellen genauso gut sind wie die ursprüngliche und das gesamte Sehvermögen wiederherstellen. Ihre Ergebnisse, veröffentlicht im Journal „Developmental Cell“, bieten vielversprechende Erkenntnisse für zukünftige Photorezeptor-Ersatztherapien.
Sehen ist ein komplexer Sinn, der von der Netzhaut abhängt. Dieses komplexe Nervengewebe im Augenhintergrund ist eigentlich ein Teil des Gehirns. Hier fangen spezielle Sehzellen, die Photorezeptoren, das Licht ein und wandeln es in elektrische Signale um. Beim Menschen können diese Photorezeptoren nicht regenerieren. Sterben sie ab, führt dies derzeit zu dauerhafter Erblindung.
Forschende des CRTD in Dresden und weitere Gruppen weltweit arbeiten an neuen Therapien, um diese verlorene Photorezeptoren zu ersetzen und so das Sehvermögen wiederherzustellen. Vielversprechende Ansätze für einen Photorezepotrersatz sind die Regeneration der Zellen aus körpereigenen Stammzellen der Retina, den so genannten Müller-Glia-Zellen oder die Transplantation von in der Zellkulturschale gezüchteten Photorezeptoren.
Im Gegensatz zum Menschen können Zebrafische Teile ihres Nervensystems, einschließlich der Netzhaut und ihrer Photorezeptoren, selbst nach schweren Schäden, vollständig erneuern. Die Müller-Glia-Zellen bilden dabei, als spezialisierte Stammzellen der Netzhaut, die neuen Photorezeptoren. Diese wunderbare Fähigkeit macht den Zebrafisch zu einem idealen Modell für die Forschung.
„Auch beim Menschen gibt es ähnliche Müller-Glia-Zellen. Diese haben im Laufe der Evolution allerdings ihre Fähigkeit zur Regeneration verloren. Vielleicht können wir diesen Prozess aber wieder ankurbeln,“ erklärt Prof. Michael Brand, Leiter der Studie. „Es ist jedoch entscheidend festzustellen, ob die neu entstandenen Photorezeptor-Zellen wieder genauso effektiv funktionieren wie die ursprünglichen.“
Unmögliches messen
Forschende wissen bereits, dass Zebrafische geschädigte Netzhäute regenerieren können, wobei neue Photorezeptoren den ursprünglichen gleichen. Verschiedene Gruppen, darunter auch die von Prof. Brand, entwickelten Verhaltenstests, die bestätigten, dass Fische nach der Regeneration ihr Sehvermögen wiedererlangen. Doch diese Tests konnten nicht direkt messen, inwieweit die Funktion der Photorezeptoren wiederhergestellt war.
„Der einzige umfassende Test, um festzustellen, ob das Sehvermögen vollständig wiederhergestellt ist, besteht darin, die elektrische Aktivität der Netzhautzellen direkt zu messen. Werden Photorezeptoren von verschiedenen Lichtfarben korrekt stimuliert? Sind sie elektrisch genauso aktiv? Sind sie mit den Nachbarzellen verbunden? Leiten sie das Signal an sie weiter? Sind alle typischen Schaltkreise aktiviert?“, sagt Prof. Brand.
Um diese Fragen zu beantworten, verwendete das Brand-Team genetisch veränderte Zebrafische und setzte zur Untersuchung „High-Tech“-Mikroskopie ein. So konnten sie die Aktivität der neu entstandenen, lebenden Photorezeptoren direkt an der Verbindungsstelle zu anderen Nervenzellen verfolgen, wo das elektrische Signal weitergeleitet wird.
Das Testen der Funktion regenerierter Photorezeptoren stellte eine erhebliche technische Herausforderung dar. Photorezeptoren wandeln Licht in elektrische Signale um. Aber die Verwendung von Licht zur Beobachtung von Zellen unter dem Mikroskop stimuliert sie gleichzeitig. Diese technische Schwierigkeit schien fast unmöglich zu überwinden. Mit Hilfe von Prof. Tom Baden von der University of Sussex in Brighton, U.K., und Dr. Hella Hartmann, Leiterin der Lichtmikroskopie-Einrichtung am Center for Molecular and Cellular Bioengineering der TU Dresden, konnte das Team jedoch ein spezielles Mikroskop entwickeln, das die gleichzeitige Stimulation und Beobachtung der lebenden Zebrafisch-Netzhaut ermöglichte.
Mit diesem speziellen Mikroskop konnte das Brand-Team zeigen, dass die neu regenerierten Photorezeptoren ihre normale physiologische Funktion wiedererlangen. Sie reagieren auf Licht, übertragen das elektrische Signal an die Nachbarzellen und tun dies mit der gleichen Empfindlichkeit, Qualität und Geschwindigkeit wie ursprüngliche Photorezeptoren in einer intakten Netzhaut.
Hoffnung für die Zukunft
„Da die regenerierten Photorezeptoren alle Funktionen wieder herstellen konnten, und wir zudem zeigen konnten, dass die Fische ihr normales Sehverhalten wieder zurückgewinnen, haben wir auf molekularer Ebene bestätigt, dass die Fische wieder vollständig ‚sehen‘ können“, sagt Prof. Brand.
„Menschen und Fische haben gemeinsame evolutionäre Wurzeln, und der größte Teil der Gene und Zelltypen ist immer noch konserviert zwischen Fisch und Mensch. Daher hoffen wir, dass es uns gelingt, diesen ‚Regenerationstrick‘ vom Zebrafisch auf den Menschen zu übertragen. Unsere Forschung ist Grundlagenforschung, und bis zur klinischen Anwendung ist es noch ein langer Weg. Doch die Möglichkeit, aus körpereigenen Stammzellen eine funktionierende Netzhaut nachwachsen zu lassen, könnte die Behandlung von Augenkrankheiten wie Retinitis pigmentosa oder Makuladegeneration revolutionieren. Unsere Studie ist ein weiterer wichtiger Schritt in diese Richtung“, schließt Prof. Brand.
Originalveröffentlichung
Evelyn Abraham, Hella Hartmann, Takeshi Yoshimatsu, Tom Baden, Michael Brand: Restoration of cone-circuit functionality in the regenerating adult zebrafish retina Developmental Cell (August 2024)
Link: https://authors.elsevier.com/sd/article/S1534-5807(24)00440-4
Über das Zentrum für Regenerative Therapien Dresden (CRTD)
Am Zentrum für Regenerative Therapien Dresden (CRTD) der TU Dresden widmen sich Spitzenforscher und -forscherinnen aus mehr als 30 Ländern neuen Therapieansätzen. Sie entschlüsseln die Prinzipien der Zell- und Geweberegeneration und ergründen deren Nutzung für Diagnose, Behandlung und Heilung von Krankheiten. Das CRTD verknüpft Labor und Klinik, vernetzt Wissenschaft und Klinik, nutzt Fachwissen in Stammzellforschung, Entwicklungs- und Regenerationsbiologie, um letztlich die Heilung von Erkrankungen wie Alzheimer und Parkinson, hämatologischen Krankheiten wie Leukämie, Stoffwechselerkrankungen wie Diabetes sowie Augen- und Knochenerkrankungen zu erreichen. Das CRTD wurde 2006 als Forschungszentrum der Deutschen Forschungsgemeinschaft (DFG) gegründet und bis 2018 als DFG-Forschungszentrum, sowie als Exzellenzcluster gefördert. Seit 2019 wird das CRTD mit Mitteln der TU Dresden und des Freistaates Sachsen finanziert.
Das CRTD ist eines von drei Instituten der zentralen wissenschaftlichen Einrichtung Center for Molecular and Cellular Bioengineering (CMCB) der TU Dresden.
www.tud.de/crtd
www.tud.de/cmcb
Bildmaterial: https://tud.link/53yw25
Medienkontakt:
Dr. Magdalena Gonciarz
Public Relations Officer
Tel: +49 (0) 351 458 82065
E-Mail:
Wissenschaftlicher Ansprechpartner:
Prof. Dr. Michael Brand
Center for Regenerative Therapies Dresden (CRTD)
Tel: +49 (0)351 458 82300
E-mail:
