25.08.2020
Auf die richtige Umgebung kommt es an: Räumliche Begrenzung ist Schlüssel zum Verständnis von Tumorinvasion
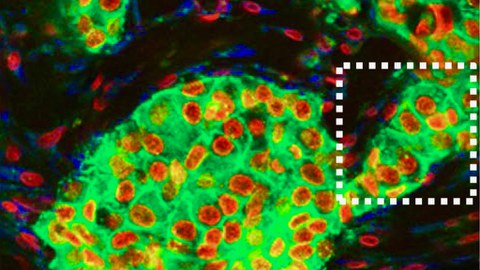
Ein fundamentales Bauprinzip multizellulären Lebens ist, dass es zwischen festen, flüssigen und gasförmigen Phasen hin- und herschalten kann: Zellen bewegen sich in der Gasphase unabhängig und bilden in der Flüssigphase lockere Verbünde oder im Festzustand dichte Gruppen. Ein internationales Forschungsprojekt mit Beteiligung der TU Dresden ermöglicht jetzt neue Einsichten in die Mechanismen der Phasenübergänge. Diese sind entscheidend für das Verständnis der Entwicklung von Organen und Organismen, aber auch für die Regulation von Wundheilung und chronischen Krankheiten, wie der Invasion von Tumoren. So kommt es bei der Invasion zu einer ungewollten Verflüssigung und der Entstehung einer Gasphase in einem vorher intakten festen Gewebe. Wissenschaftler des Zentrums für Informationsdienste und Hochleistungsrechnen (ZIH) konnten mit Hilfe mathematischer Modellierung und Computersimulation die Identifikation des Schaltmechanismus unterstützen.
In einer interdisziplinären Studie identifizierten biologische, biophysikalische und mathematische Forschungsgruppen aus den Niederlanden, Italien und Deutschland nun einen neuen Schaltmechanismus. Sie konnten zeigen, dass dem Bindegewebe eine entscheidende Rolle zukommt: Die bloße Veränderung der räumlichen Begrenzung in der Umgebung kann die Verflüssigung bzw. Verfestigung des Gewebes regulieren. In ihrer Studie kombinierten die Wissenschaftler neuartige Gewebekulturen von Brustkrebszellen und Lebendmikroskopie mit innovativer mathematischer Modellierung und regulierten die Stärke der Zell-Zell-Kontakte mit molekularen Methoden. Sie zeigen, dass Tumorzellen, selbst ohne starke Zell-Zell-Kontakte, als Gruppe in einem flüssigkeitsartigen Zustand wandern, wenn das Gewebe die Zellvereinzelung verhindert. Dieser Befund ermöglicht ein tieferes Verständnis für den Übergang von lokaler zu metastasierender Tumorerkrankung.
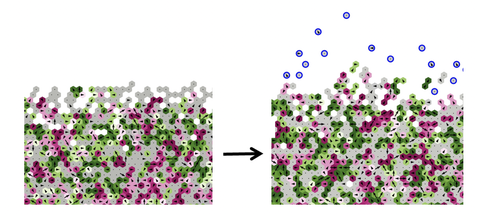
Gewebeverflüssigung und Entstehung einer Gasphase (einzelne Zellen, blau) in der Computersimulation des mathematischen Modells: Durch Verkleinerung der lokalen räumlichen Begrenzung kann es zum Ablösen einzelner Zellen kommen.
Die internationale Zusammenarbeit wurde von Prof. Dr. Peter Friedl (Radboud Universität Nijmegen, Niederlande) koordiniert. Prof. Andreas Deutsch, Jörn Starruß und Simon Syga vom ZIH der TU Dresden waren für die mathematische Modellierung verantwortlich. Die Ergebnisse wurden in der Fachzeitschrift Nature Cell Biology veröffentlicht und sich hier frei verfügbar: https://www.nature.com/articles/s41556-020-0552-6
Informationen für Journalisten
Prof. Andreas Deutsch
TU Dresden / Zentrum für Informationsdienste und Hochleistungsrechnen (ZIH)
Tel.: +49 351 463-31943