Forschungsüberblick
DNA und Chromosomendynamik
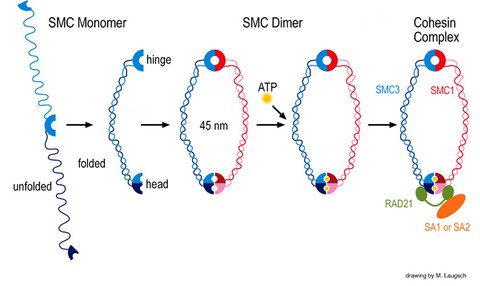
In einem unserer Projekte untersuchen wir, wie SMC-Proteine in der DNA-Rekombination und –Reparatur, der Kohäsion von Schwesterchromatiden und ähnlichen Prozessen wirken. Die evolutionär hochkonservierte eukaryotische Familie der SMC-Proteine mit sechs Vertretern, SMC1 bis SMC6, ist an verschiedenen Schlüsselprozessen im Zellkern beteiligt. Die SMC-Familie wurde Ende 1994 als solche definiert und unsere Veröffentlichung im Jahr 1996 war die erste zu SMC-Proteinen bei Säugern. Prozesse, bei denen SMC-Proteine eine Rolle spielen, sind Chromosomenkondensation, Kohäsion von Schwesterchromatiden, DNA-Rekombination und –Reparatur sowie Mitose und Meiose. SMC-Proteine weisen eine charakteristische Proteinstruktur auf mit helikalen Domänen flankiert von globulären N- und C-terminalen Domänen, sowie zentral eine flexible Gelenkdomäne. Die sechs verschiedenen SMC-Proteine bilden drei Arten von Heterodimeren: SMC1 & SMC3, SMC2 & SMC4 sowie SMC 5 & SMC6. Diese Heterodimere sind zentrale Komponenten größerer Multiproteinkomplexe, welche spezielle, ATP-gesteuerte Funktionen in der Chromosomendynamik übernehmen.
SMC Proteine und Cohesin
Unsere Forschung konzentriert sich auf das Säugerheterodimer SMC1/3, welches Teil des Schwesterchromatidkohäsionskomplexes Cohesin ist. Wir identifizierten eine meiosespezifische Variante des SMC1, SMC1ß, welches überwiegend für die Schwesterchromatidkohäsion bis zur Anaphase II der Meiose verantwortlich ist. Seine Funktion während der Meiose und sein potenzielles Versagen in Fällen von Sterilität und verschiedener Krankheitsbilder aufgrund von Chromosomenfehlverteilung wird in unserem Labor zurzeit biochemisch mit SMC1ß-defizienten Mausmodellen erforscht. Das Fehlen von SMC1ß führt zu starken meiotischen Phänotypen wie 50 % kürzeren Chromosomenachsen und zeigt nachdrücklich, dass SMC1ß für die meiotische Kohäsion, Synapse, DNA-Rekombination und das Telomerverhalten unerlässlich ist.
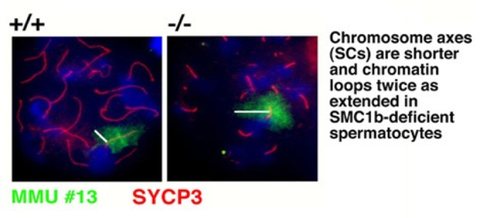
Chromosomenachsen sind kürzer und Chromatinausdehnung doppelt so groß in SMC1ß-defizienten Spermatozyten
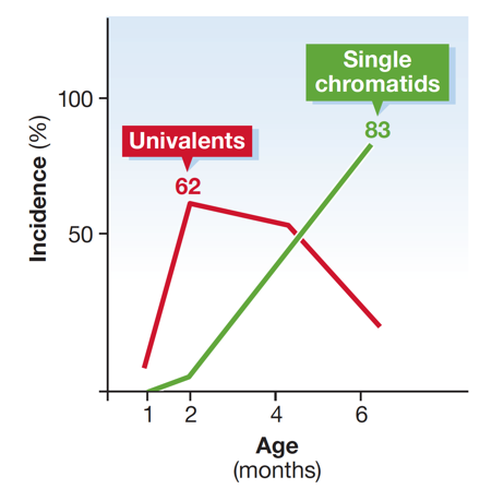
Wir bewiesen bereits, dass es einen altersabhängigen Anstieg von Aneuploidien bei SMC1ß-defizienten Oozyten gibt, ein einzigartiges Modell für menschliche Syndrome wie Trisomie 21, welche auf Chromosomenfehlverteilung beruhen. Kürzlich begannen wir mit der Erforschung der Bedeutung von Cohesinregulatoren, da diese eine Schlüsselrolle in der Langzeitfunktionalität von Cohesin in arretierten Oozyten spielen könnten.
Anstieg ungepaarter Chromosomen und einzelner Schwesterchromatide in SMC1ß-defizienten Mausoozyten mit zunehmendem Alter. Dies tritt bei Wildtypoozyten nicht auf. Der Verlust von Schwesterchromatidkohäsion ist die Ursache für Chromosomenfehlverteilung und daher für Aneuploidien.
Eine weitere Ergänzung des Forschungsportfolios in diesem Bereich ist die Analyse eines Proteins mit multiplen Tudordomänen, TDRD6, welches eine bedeutende Rolle bei der miRNA-Regulation und der Bildung von sog. chromatoid bodies in Keimzellen spielt, wie ein von uns generiertes Knockout-Mausmodell bereits zeigte. Innerhalb des chromatoid bodies kontrolliert TDRD6 den Nonsense-vermittelten RNA-Abbau in Spermatiden.
Erst kürzlich begannen wir die Hypothese zu untersuchen, dass keimzellspezifische und insbesondere meiotische Gene, in die Tumorgenese somatischer Gewebe involviert sind. Verschiedene Beweisketten unterstützen diese Hypothese, welche neue Wege in der Tumorcharakterisierung und vielleicht bei therapeutischen Ansätzen ebnen könnte.
Aktivierung von hämatopoietischen Zellen
Unser zweites Forschungsgebiet betrifft die Aktivierung von hämataopoietischen Zellen wie B-Zellen, Mastzellen, Osteoklasten, dendritische Zellen und von Signalwegen, welche in diesen Prozessen involviert sind. Derzeit konzentrieren wir uns auf die Eigenschaften und Funktionen des von uns identifizierten Proteins SWAP-70 und das ähnliche DEF6/IBP.
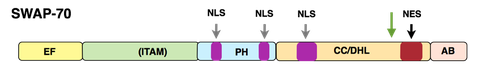
Struktur SWAP-70
Das Protein SWAP-70 wurde ursprünglich von uns aus aktivierten, reifen murinen B-Zellen isoliert. Es kombiniert in einzigartiger Weise Merkmale von Signalproteinen, pendelt zwischen zytoplasmatischen Membranen, Zytoplasma und Zellkern in aktivierten B-Zellen, aber ist in anderen Zellen nur in der zytoplasmatischen Membran und im Zytoplasma vorhanden. In B-Zellen ist SWAP-70 am Immunoglobulin- Klassenwechsel beteiligt, insbesondere am Wechsel zum IgE-Isotyp, dem „Allergieisotyp“. Wir konnten SWAP-70 als PIP3-bindendes Protein charakterisieren. Es ist ein Ras-unabhängiges, Rac-interagierendes und F-Actin bindendes Protein, welches sich durch seine Pleckstrin-Homologiedomäne (PH) mit der zytoplasmatischen Membran verbindet und F-Actin-Strukturen lokalisiert. SWAP-70 bündelt F-Actin und verhindert so die Depolymerisierung der Filamente; es bindet und inhibiert auch Cofilin, ein F-Actin abbauendes Protein..
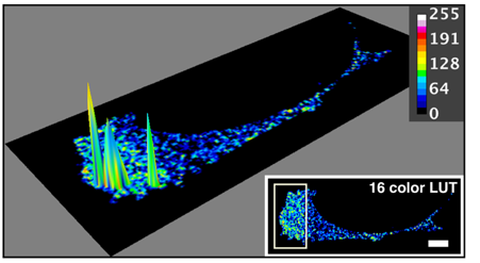
Kolokalisation von SWAP-70 und Cofilin in einer aktivierten Zelle, mit FRET gemessen
Unsere SWAP-70 defizienten Mäuse bzw. davon abgeleitete Zellen zeigen verschiedene spezifische Phänotypen, so z. B. Defizite bei der CD-40-Signalisierung in B-Zellen mit IgE-Klassenwechsel, Störung der Mastzelldegranulation, Versagen bei der Bildung von F-Actin-Ringen in Osteoklasten, Defizite bei der Actin-Reorganisation in Membranen bei einer Vielzahl von Zellen, einen Autoimmunphänotyp und erhöhter Zelltod als Folge von DNA-Schädigungen.

Modell von SWAP-70's Rolle als Unterstützer der IgE-Produktion
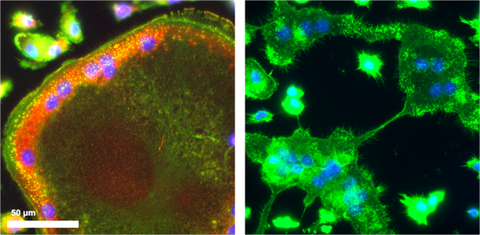
Abwesenheit von F-Actin-Ringen in SWAP-70 defizienten Osteoklasten, welche nicht fusionieren können (rechts); SWAP-70, rot; F-Actin, grün