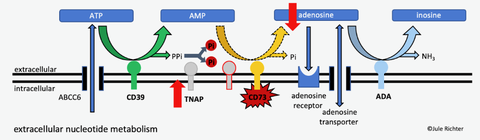
Nukleotid- und Nukleosid-Stoffwechsel
In den letzten Jahren konnten wir zusammen mit Kolleg:innen biochemische Modelle, die auf Ansätzen des Massen-Wirkungsgesetzes beruhen und aus mathematischer Sicht Systeme gekoppelter Differentialgleichungen darstellen, auf verschiedenste (zell-)physiologische Systeme anwenden. Hierzu gehören die Wirkungen von Hormonen der Nebenniere, der Stoffwechsel und die Verteilung von bio-aktiven Peptiden sowie der (meist extra-zelluläre) Nukleotid- und Nukleosid-Stoffwechsel.
Als Beispiel sei der extra-zelluläre Nukleotid- und Nukleosid-Stoffwechsel in der Abbildung oberhalb etwas genauer betrachtet: Dieser ist in die Entwicklung verschiedenster Krankheitsbilder (u. a. Diabetes, Tumorbildung, ektopische Kalzifizierung) involviert. Hierbei wird von der Zelle freigesetztes ATP (bzw. auch NAD) über verschiedene Enzyme hin zum Hypoxanthin abgebaut. In der Literatur wurde bisher meist angenommen, dass ATP eine inflammatorische und Adenosin eine anti-inflammatorische Wirkung haben. Dies hat das Enzym CD73 (AMP → Adenosin) als therapeutisches Target in den Mittelpunkt vieler Studien gestellt.
Aktuelle Arbeiten von Doktorand:innen in unserer Arbeitsgruppe untersuchen die Rolle der CD73 im Kontext ektopischer Kalzifizierung von Gefäßen. Hier konnten wir Ergebnisse des enzymatischen Abbaus aus dem Zellkulturexperiment mit Hilfe eines mathematischen Modells auf die Verhältnisse eines Gefäßringsegments übertragen. Der komplizierte Abbau von Nukleotiden und Nukleosiden sowie deren Verteilung in den Gefäßschichten über diffusive Prozesse legen nahe, dass es hier zum Auftreten von Kipp-Punkten kommen könnte, an denen die Kalzifizierung des Gefäßes einsetzt.
Dabei – und das gilt sicher ganz allgemein für die Netzwerke von Stoffwechselprozessen – müssen Techniken entwickelt werden, die eine einfache Extraktion der signifikanten Modellparameter aus einer (meist zu) großen Anzahl von Parametern aller biochemischen Reaktionen erlauben. Hier sehen wir Perspektiven für weitere Arbeiten sowie die Anwendung auf andere Fragestellung, insbesondere bei der Entwicklung von Krankheitsbildern.
- Mangelis A, Jühlen R, Dieterich P, Peitzsch M, Lenders JWM, Hahner S, Schirbel A, Eisenhofer G. A steady state system for in vitro evaluation of steroidogenic pathway dynamics: Application for CYP11B1, CYP11B2 and CYP17 inhibitors. The Journal of Steroid Biochemistry and Molecular Biology V188, 38-47 (2019).
-
Michelke L, Deussen A, Dieterich P, Martin M. Effects of bioactive peptides encrypted in whey-, soy- and rice protein on local and systemic angiotensin-converting enzyme activity. Journal of Functional Foods. 2017. 28:299–305 (2017).
- Hesse J, Leberling S, Boden E, Friebe D, Schmidt T, Ding Z, Dieterich P, Deussen A, Roderigo C, Rose CR, Floss DM, Scheller J, Schrader J. Cytokine formation by epicardium-derived cells is controlled by purinergic signalling and tenascin-C. FASEB J 31(7), 3040-3053 (2017).
- Mangelis A, Dieterich P, Peitzsch M, Richter S, Huebner A, Deussen A, Lenders JWM, Eisenhofer G. Computational modeling of steroidogenic pathways in NCI H295R cells following angiotensin II, forskolin and abiraterone treatment. J Steroid Biochem Mol Biol 155, 67-75 (2016).