23.10.2019
Expression von Aldh1b1 markiert adulte pankreatische Vorläuferzellen und ist für Kras-induzierten Bauchspeicheldrüsenkrebs erforderlich
Diabetes und Bauchspeicheldrüsenkrebs gehören zu den verheerendsten Erkrankungen der Bauchspeicheldrüse. Die Identifikation von organspezifischen adulten Vorläufer- und Stammzellen ist daher für das Verständnis ihrer Herkunft und die Konzeption therapeutischer Maßnahmen von großer Bedeutung. Forscher des Paul-Langerhans-Instituts Dresden und des Helmholtz-Zentrums München haben in Zusammenarbeit mit Kollegen der „Biomedical Research Foundation of the Academy of Athens“ herausgefunden, dass seltene Aldh1b1 exprimierende Zellen Vorläuferzellen im adulten Mauspankreas sind und dass Aldh1b1 in einem Mausmodell bei der Tumorentwicklung des Bauchspeicheldrüsenkrebs beteiligt ist. Die Resultate der Studie deuten darauf hin, dass diese Zellen eine Schlüsselrolle bei der Entwicklung der Pankreas-Homöostase und des Bauchspeicheldrüsenkrebses spielen und möglicherweise ein therapeutisches Ziel für Bauchspeicheldrüsenkrebs darstellen. Die Ergebnisse dieses internationalen Forschungsprojekts wurden nun in der renommierten Zeitschrift "Proceedings of the National Academy of Sciences of the United States of America (PNAS)" veröffentlicht.
Die Identifikation von organspezifischen adulten Vorläufer- und Stammzellen ist wichtig, um die Entstehung von Krankheiten zu verstehen und therapeutische Maßnahmen entwickeln zu können. Beispiele dafür sind Krankheiten wie Diabetes oder Bauchspeicheldrüsenkrebs, zwei der verheerendsten Erkrankungen der Bauchspeicheldrüse. Die adulte Bauchspeicheldrüse kann auf Verletzungen oder Stoffwechselreize reagieren, um beispielsweise Schäden zu reparieren oder ihre Zellmasse den metabolischen Bedürfnissen anzupassen. Jedoch wird derzeit diskutiert, ob dies auf die inhärente Plastizität bereits ausdifferenzierter Zellen oder auf das Vorhandensein unidentifizierter seltener adulter pankreatischer Stamm- bzw. Vorläuferzellen zurückzuführen ist. Eine vergleichbare kontroverse Diskussion gibt es auch bzgl. der Ursprungszellen für das pankreatische duktale Adenokarzinom (PDAC), welches eines der tödlichsten Malignome darstellt.
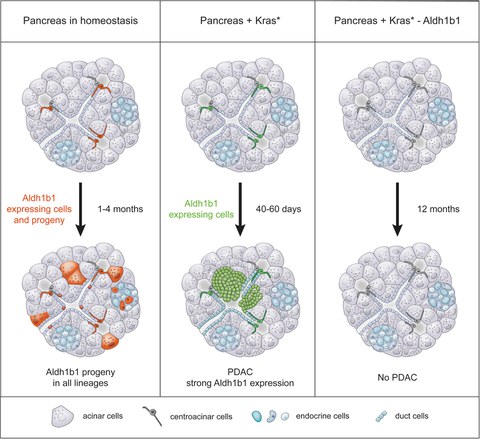
"In mehr als 90% der Fälle wird ein PDAC durch eine onkogene Mutation der GTPase Kras ausgelöst", erklärt Dr. Anthony Gavalas, Forschungsgruppenleiter am Paul-Langerhans-Institut Dresden des Helmholtz-Zentrums München am Universitätsklinikum und der Medizinischen Fakultät Carl Gustav Carus der TU Dresden und leitender Autor der Studie. "Vor kurzem haben wir eine kleine Population von sich selbst erneuernden Vorläuferzellen in der adulten Bauchspeicheldrüse der Maus identifiziert, die durch die Expression eines mitochondrialen Enzyms namens Aldh1b1 gekennzeichnet sind. Interessanterweise entstehen aus diesen Zellen im Erwachsenenalter alle drei im Organ nötigen Zelltypen, die endokrinen, die duktalen und die azinaren Zellen ", so Dr. Gavalas weiter.
"In der vorliegenden Studie haben wir „Single-Cell-Genexpressionsanalysen“ verwendet und festgestellt, dass diese Aldh1b1-positiven Vorläufer- bzw. Stammzellen bevorzugt Kras exprimieren, dessen Mutationen mehr als 90% der Fälle von Bauchspeicheldrüsenkrebs ausmachen", sagt Dr. Ekaterina Mameishvili, die Erstautorin der Studie, und Dr. Ioannis Serafimidis, ein Hauptautor der Studie, ergänzt: "Unsere Untersuchungen haben weiterhin ergeben, dass die Aldh1b1-Funktion für die Entwicklung von Bauchspeicheldrüsenkrebs nötig ist, was darauf hindeutet, dass diesen Zellen eine Schlüsselrolle bei der Entstehung der Krankheit zukommt. Der Mechanismus, mit dem die Aldh1b1-Aktivität eine Kras-vermittelte onkogene Transformation ermöglicht, erfordert in Zukunft noch weitere Untersuchungen, aber es scheint, als hätten wir ein potenzielles neues therapeutisches Ziel für Bauchspeicheldrüsenkrebs identifiziert."
Originalpublikation:
Aldh1b1 expression defines progenitor cells in the adult pancreas and is required for Kras-induced pancreatic cancer. Mameishvili E, Serafimidis I, Iwaszkiewicz S, Lesche M, Reinhardt S, Bölicke N, Büttner M, Stellas D, Papadimitropoulou A, Szabolcs M, Anastassiadis K, Dahl A, Theis F, Efstratiadis A, Gavalas A. Proc Natl Acad Sci U S A. 2019 Sep 23. pii: 201901075. doi: 10.1073/pnas.1901075116. [Epub ahead of print)
Link: https://www.pnas.org/content/early/2019/09/17/1901075116.long
Kontakt:
Dr. Anthony Gavalas
Paul Langerhans Institute Dresden at the Helmholtz Center Munich and the University Clinic Carl Gustav Carus and Medical Faculty of the TU Dresden
Fetscherstraße 74
01307 Dresden
Email: anthony.gavalas@tu-dresden.de
Phone: +49 351 458 82002
Fax: +49 351 796 36698
Internet: https://tu-dresden.de/med/mf/plid/forschung/Gavalas