13.05.2025
Neue Erkenntnisse über die Speicherung von Insulin mRNA in Betazellen bei niedrigem Blutzuckerspiegel
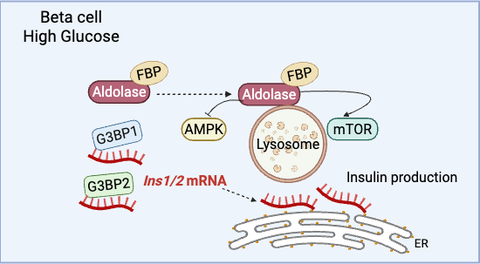
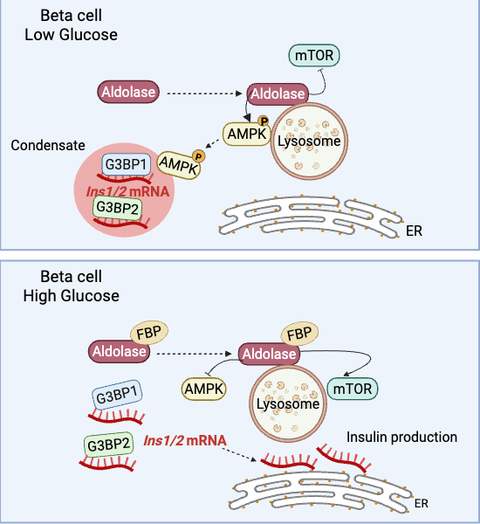
Typ-2-Diabetes (T2D) ist eine Erkrankung, die zu einer unzureichenden Produktion von Insulin, dem von der Bauchspeicheldrüse ausgeschütteten glukoseregulierenden Hormon, führt. Bei einem Anstieg des Blutzuckerspiegels translatieren die Betazellen der Bauchspeicheldrüse bereits vorhandene Insulin-Transkriptvarianten (Ins1/2 mRNA), um das aktive Hormon zu produzieren. In einer neuen Studie untersuchte ein Forscherteam unter der Leitung von WissenschaftlerInnen des Paul-Langerhans-Instituts Dresden (PLID) des Deutschen Zentrums für Diabetesforschung die Mechanismen, mit denen Betazellen der Maus Ins1/2 mRNA bei niedrigem Blutzuckerspiegel speichern. Die Forschenden stellten fest, dass das RNA-Bindungsprotein G3BP1, das in den Pankreasinseln von T2D-Patienten im Vergleich zu normoglykämischen Spendern schwächer exprimiert wird, unter Nüchternbedingungen die Insulin mRNA in zytosolische Kondensate kompartimentiert. Werden die Zellen anschließend einer erhöhten Glukosekonzentration ausgesetzt, z. B. nach der Einnahme einer Mahlzeit, lösen sich diese intrazellulären Kondensate auf und ermöglichen so die sofortige Übersetzung der Insulin mRNA in das aktive Hormon. Diese kürzlich in der Zeitschrift EMBO Journal veröffentlichten Forschungsergebnisse liefern neue Erkenntnisse über die Speicherung von Insulin mRNA, die in der Forschung seit vielen Jahren ein Rätsel darstellt, und werfen die Möglichkeit auf, dass dieser Prozess bei Patienten mit T2D beeinträchtigt sein könnte.
Pankreatische Betazellen sind der körpereigene Produzent von Insulin, dem Peptidhormon, das die Aufnahme von Glukose in die Körperzellen ermöglicht. Eine gestörte Betazellfunktion und Insulinresistenz sind die Hauptfaktoren, die T2D verursachen. Patienten, die an T2D leiden, haben demzufolge Probleme mit der Aufnahme von Glukose in ihre Zellen, da sie nicht genügend Insulin produzieren können, um hohe Blutzuckerwerte zu regulieren. Frühere Studien haben ergeben, dass die Neusynthese von Insulinmolekülen in den Betazellen als Folge eines Blutzuckeranstiegs nicht von einer gesteigerten Insulin-Genexpression abhängt, sondern vielmehr von einer erhöhten Translation bereits vorhandener Ins1/2 mRNA Transkripte. Dies bedeutet, dass die Insulin-mRNA irgendwo im Zytosol der Betazellen gespeichert wird, wenn sie nicht benötigt wird, z. B. beim Fasten. Wie und wo Betazellen Ins1/2 mRNA speichern, bleibt damit ein Rätsel.
"In einer vorangegangenen Studie haben transkriptomische Analysen von Laser-Capture-Mikrodissekten Pankreasinseln verschiedener Spender gezeigt, dass G3BP1 bei Patienten mit T2D am stärksten herunterreguliert ist", erklärt Esteban Quezada, Postdoktorand im Labor von Michele Solimena und Erstautor der Studie. "Aus diesem Grund haben wir uns entschlossen, genauer zu untersuchen, wie G3BP1 und sein Paralog G3BP2 an der Ins1/2 mRNA-Speicherung beteiligt sein könnten."
Um dies aufzuklären, untersuchte eine Forschergruppe aus Wissenschaftlern verschiedener Institutionen unter der Leitung von Michele Solimena den möglichen Zusammenhang zwischen der Insulin mRNA-Speicherung und dem Stressgranula-Marker G3BP1 während des Fastens. Stressgranula sind zytosolische Kompartimente, die aus RNA-bindenden Proteinen und verschiedenen mRNAs bestehen und sich unter verschiedenen Stressbedingungen bilden. Niedrige Blutglukosespiegel werden jedoch nicht als Stressbedingung, sondern eher als physiologischer Zustand betrachtet, so dass die Betazellen möglicherweise ähnliche Mechanismen nutzen könnten, um die Ins1/2 mRNA als Reaktion auf den geringen Blutzuckerspiegel zu speichern.
Diese neue Studie, die in Betazellen von Mäusen und Menschen durchgeführt wurde, ergab, dass die Ins1/2 mRNA bei niedrigen Blutzuckerspiegeln in G3BP1/2-positiven Kondensaten eingeschlossen ist. Interessanterweise lösten sich die Kondensate auf, wenn die Zellen höheren Glukosespiegeln ausgesetzt wurden, und die Komponenten wurden im Zytosol neu verteilt. Bei näherer Betrachtung wurde darüber hinaus deutlich, dass G3BP1, aber nicht G3BP2, zur Stabilität von Ins1/2 und zur Proinsulinproduktion beiträgt. Wichtig ist, dass das Vorhandensein von G3BP1/2-positiven Kondensaten, die Insulin mRNA einschließen, in primären Betazellen der Maus und in Gewebeschnitten der menschlichen Bauchspeicheldrüse bestätigt werden konnte. Diese Ergebnisse deuten darauf hin, dass verringerte G3BP1-Spiegel eine wichtige Rolle bei der T2D Pathologie und dem Mechanismus spielen könnten, durch den die Insulinproduktion bei diesen Menschen gehemmt wird. "Zusammenfassend lässt sich sagen, dass das weitere Verständnis dieses Mechanismus sich als nützliches Instrument für die komplexe Behandlung von T2D erweisen könnte", schließt Michele Solimena und plant, die Untersuchung dieses Themas fortzusetzen.
Originalpublikation
Esteban Quezada, Klaus-Peter Knoch, Jovana Vasiljevic, Annika Seiler, Akshaye Pal, Abishek Gunasekaran, Carla Münster, Daniela Friedland, Eyke Schöniger, Anke Sönmez, Pascal Roch, Carolin Wegbrod, Katharina Ganß, Nicole Kipke, Simon Alberti, Rita Nano, Lorenzo Piemonti, Daniela Aust, Jürgen Weitz, Marius Distler, and Michele Solimena. Aldolase-regulated G3BP1/2+ condensates control insulin mRNA storage in beta cells. https://doi.org/10.1038/s44318-025-00448-7