23.04.2020
Neuer Ansatz zur Untersuchung der Pathogenese der menschlichen Bauchspeicheldrüse in der Entstehung des Typ-1 Diabetes
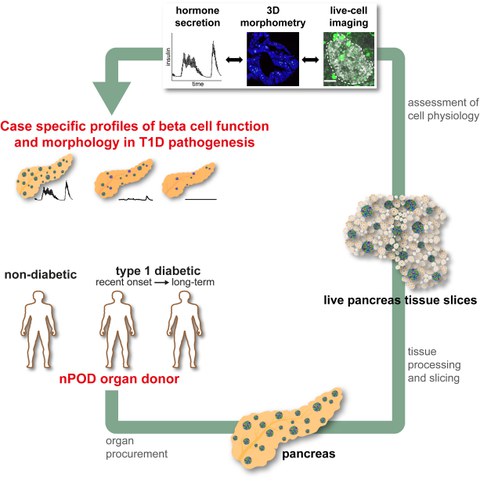
Schematische Darstellung des neuentwickelten Ansatzes bei dem Pankreas-Gewebeschnitte von Spenderorganen aus verschiedenen Stadien des T1D zur Gewinnung fallspezifischer pathophysiologischer Pankreas-Profile und dem Erkenntnisgewinn in der T1D Pathogenese genutzt werden.
Beim Typ-1-Diabetes (T1D) führt eine Autoimmunreaktion zur Zerstörung der pankreatischen Betazellen, und dadurch zu Insulinmangel und dem Verlust der Blutzuckerkontrolle. Das Wissen über die Pathogenese des T1D ist bisher jedoch unvollständig, auch weil es an Technologien fehlt die Vorgänge in der lebenden menschlichen Bauchspeicheldrüse in T1D zu untersuchen. Um diese Einschränkung zu beheben, entwickelte ein internationales Team unter der Leitung von Prof. Stephan Speier vom Paul-Langerhans-Institut Dresden am Helmholtz Zentrum München, zusammen mit dem Network for Pancreatic Organ Donors with Diabetes (nPOD), eine neue Methode, die erstmals die detaillierte Untersuchung von intaktem, lebendem Pankreasgewebe von Organspendern in verschiedenen Stadien der T1D-Pathogenese ermöglicht. Die Ergebnisse dieser Zusammenarbeit sind nun in 'JCI Insight' erschienen.
Typ-1-Diabetes (T1D) ist eine chronische Autoimmunerkrankung, die durch die selektive Zerstörung der insulinproduzierenden Betazellen gekennzeichnet ist. Dies führt zu einer massiven Reduktion der Betazellmasse, Insulinmangel und Hyperglykämie. Es ist bekannt, dass genetische Veranlagungen sowie Umweltfaktoren zur Entwicklung und zum Ausbruch der Autoimmunität beitragen. Jedoch sind die zellulären Prozesse, die dem Verlust an funktioneller Betazellmasse in der Bauchspeicheldrüse zugrunde liegen und zum Ausbruch des Diabetes führen, nicht vollständig aufgeklärt.
Ein Großteil des aktuellen Wissens über die Pathogenese der Krankheit wurde aus Studien in Tiermodellen abgeleitet. Obwohl diese für unser aktuelles Verständnis von großer Bedeutung sind, bilden diese Tiermodelle nicht alle Aspekte des menschlichen T1D ab. "In den letzten 10-15 Jahren wurden enorme Anstrengungen unternommen, Forschern Gewebe von Organspendern zur Verfügung zu stellen, um Untersuchungen der menschlichen T1D-Pathogenese zu ermöglichen", erklärt der Seniorautor Prof. Stephan Speier, Gruppenleiter am Paul-Langerhans-Institut Dresden (PLID) und Professor für Inselzellphysiologie an der TU Dresden. "Leider erlaubten die verfügbaren Methoden keine funktionellen Untersuchungen von intaktem, lebensfähigem Spendergewebe, wodurch die Informationen über krankheitsrelevante Mechanismen, die aus diesen Organen gewonnen werden konnten, limitiert waren. Um diese Einschränkung zu überwinden, haben wir nun eng mit dem Network for Pancreatic Organ Donors with Diabetes (nPOD) zusammengearbeitet. Das nPOD Netzwerk ist an der University of Florida angesiedelt und koordiniert für die Forschung die größte Initiative zur Bereitstellung von Bauchspeicheldrüsen von Organspendern mit T1D, sowie von Organspendern ohne Diabetes, positiv oder negativ für krankheitsrelevante Autoantikörper".
Zusammen mit den Kooperationspartner am University of Florida Diabetes Institute, am Diabetes Research Institute Miami und an der University of Miami, wurde eine zuvor von der Arbeitsgruppe von Prof. Stephan Speier am PLID entwickelte Plattform für die Präparation von Gewebeschnitten von Spenderpankreata des nPOD Netzwerks weiterentwickelt. „In der hier vorgestellten Studie können wir zeigen, dass von der Bauchspeicheldrüse nicht-diabetischer (ND) und T1D Organspender lebende Gewebeschnitte präpariert werden können. Die erhaltenen Schnitte ermöglichten es uns zum ersten Mal die Physiologie endokriner, exokriner und immunologischer Gewebekompartimente und deren Interaktionen in ihrer natürlichen Gewebsumgebung während der Entwicklung und Progression von T1D zu untersuchen. Durch die parallele Untersuchung der Gewebemorphologie und Zellphysiologie, sowie deren Korrelation mit klinischen Daten, waren wir in der Lage, fallspezifische Profile der Pathophysiologie der Bauchspeicheldrüse im T1D-Diabetes zu entwickeln.“, so Prof. Speier.
"Über nPOD haben wir diese Plattform nun einer Vielzahl an Wissenschaftlern zugänglichen gemacht, indem wir Pankreasgewebeschnitte der Spenderorgane Laboren mit komplementären Technologien und Fachkenntnissen zur Verfügung stellen. Wir gehen nun in koordinierter und beispielloser Weise wichtige offene Fragen der T1D-Pathogenese in Spenderorganen an, die sich in verschiedenen Stadien des Krankheitsverlaufs befinden. Wir sind daher optimistisch, dass wir auf diesem Weg unser Wissen über die Mechanismen erweitern können, die der T1D-Entwicklung und der Heterogenität dieser Krankheit zugrunde liegen, um dadurch die Entwicklung erfolgreicher neuer T1D-Therapien zu unterstützen.", schließt Prof. Speier ab.
Weitere Informationen
Panzer JK, Hiller H, Cohrs CM, Almaca J, Enos SJ, Beery M, Cechin S, Drotar DM, Weitz JR, Santini J, Huber MK, Qadir MMF, Pastori RL, Domínguez-Bendala J, Phelps EA, Atkinson MA, Pugliese A, Caicedo A, Kusmartseva I and Speier S. Pancreas tissue slices from organ donors enable in situ analysis of type 1 diabetes pathogenesis. https://doi.org/10.1172/jci.insight.134525.
