Bioelektrochemie
Inhaltsverzeichnis
Cytochrom-c-Oxidase (CcO)
Cytochrom-c-Oxidase (CcO) katalysiert die Reduktion von Sauerstoff zu Wasser im letzten Schritt der Atmungskette. Die Energie, die während dieses katalytischen Zyklus freigesetzt wird, wird für den Aufbau eines Transmembranpotentials durch das Pumpen von Protonen über die Membran genutzt. Die Protonierungsdynamik ist eng an den intramolekularen Elektronentransfer von CcO gekoppelt, der über vier interne Redoxzentren erfolgt: CuA, heme a, heme a3 und CuB. Die beiden Häm-Cofaktoren sowie deren direkte Umgebung können selektiv mittels Resonanz-Raman-Spektroskopie (RR) überwacht werden. Mit Hilfe von zeitaufgelösten und potenzialabhängigen RR- und SERR-Spektroskopiemethoden wollen wir den Zusammenhang zwischen Elektronentransfer, Katalyse und Protonendynamik verstehen. Diese Untersuchungen sind Teil des SFB1078 "Proteinfunktion durch Protonierungsdynamik".
Weitere Informationen finden Sie in:
Oxidation von Kohlenwasserstoffen
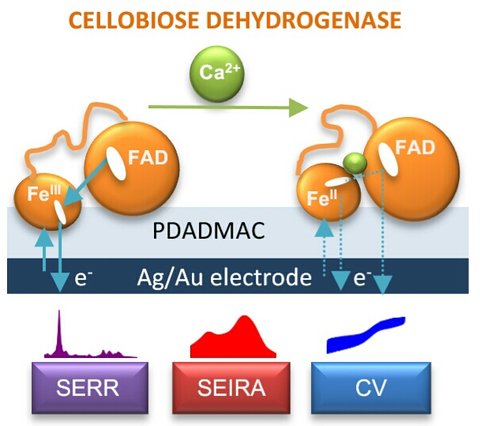
Die enzymatische Oxidation von Kohlenwasserstoffen wie Glukose oder Laktose ist ein Schlüsselelement bei der Entwicklung von Biomasse-Brennstoffzellen oder selbstversorgten in-vivo-Geräten. Wir untersuchten Cellobiose-Dehydrogenase, die an Elektroden aufgebracht ist, als einen vielversprechenden enzymatischen Katalysator, der einen direkten Elektronentransfer zur Elektrode ermöglicht. Wir konnten zeigen, dass die Zugabe von zweiwertigen Ionen wie Ca2+ in der Lage ist, die Elektronentransferwege von CDH und der Elektrode zu verändern, was zu einer höheren Effizienz der Bio-Anode führt.
Weitere Informationen finden Sie in: