24.02.2022
Immunzellen vergessen Kulturschock
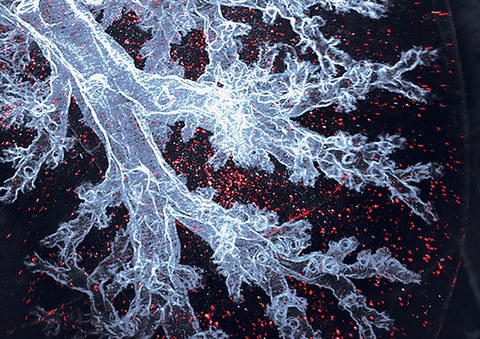
Alveolarmakrophagen sind die Immunzellen, die speziell in den Lungenbläschen leben, hier als rote Punkte in einer ansonsten transparenten Mauslunge sichtbar.
Eine neue Studie zeigt, dass bestimmte Immunzellen wieder normal funktionieren können, wenn sie nach einer Vermehrung unter Laborbedingungen wieder zurück in den Körper gebracht werden - diese Ergebnisse ebnen den Weg für neue Zelltherapien.
Makrophagen sind Immunzellen, die für die Immunantwort, die Gewebereparatur und die Beseitigung von Krebszellen wesentlich sind. Die Wissenschaft sieht Makrophagen als vielversprechende lebende Therapeutika an. Um jedoch wirksam für Therapien eingesetzt werden zu können, müssen Makrophagen in Laborkulturen in großer Anzahl kultiviert werden, ohne dass sie ihre speziellen Funktionen verlieren. Bislang war unklar, ob dies überhaupt möglich ist. Forschende aus Dresden und Marseille berichten nun, dass Makrophagen wieder normal funktionieren können, wenn sie nach langer Kultivierung im Labor zurück in den Körper transferiert werden und dass sie sich dabei nicht von den Zellen unterscheiden, die das Gewebe nie verlassen haben. Die Ergebnisse ebnen den Weg für neue Zelltherapien auf Makrophagenbasis. Die Studie wurde in der Fachzeitschrift Nature Immunology am 24. Februar 2022 veröffentlicht.
Makrophagen sind Immunzellen, die in jedem Organ unseres Körpers vorkommen. Dabei erfüllen sie eine wichtige Pflegefunktion für das umliegende Gewebe, indem sie Zellen mit Wachstumsfaktoren versorgen und schädliche Substanzen wie Bakterien, Zelltrümmer und sogar Tumorzellen entfernen. Daher sieht die Wissenschaft Makrophagen als potenzielle neue lebende Arzneimittel zur Heilung geschädigter Organe, Bekämpfung von Infektionen und der Krebsbekämpfung. Um dies zu erreichen, müssen die Zellen jedoch außerhalb des Körpers in großer Zahl vermehrt werden. Bislang war dies bei Makrophagen schwierig. Darüber hinaus gab es ernsthafte Bedenken, dass sie unter Laborbedingungen ihre besonderen Fähigkeiten verlieren könnten.
Die Vermehrung von Zellen im Labor, die sogenannte Zellkultur, ist eine gängige Technik, die im Laufe der Jahre enorme Fortschritte in Biologie und Medizin ermöglicht hat. Allerdings sind die im Zellkulturen gehaltenen Zellen außerhalb ihrer natürlichen Umgebung und somit nicht den Körpersignalen ausgesetzt, die für ihre Funktion wesentlich erscheinen. Die Zellen werden in Plastikkulturschalen vermehrt und mit künstlichen Nährlösungen versorgt. Sie müssen sich an diese neuen Bedingungen anpassen - ein echter Kulturschock. „Wir wollten genau wissen, wie sich die Zellen bei längerer Zellkultur verändern und ob diese Veränderungen dauerhaft sind oder nicht", sagt Prof. Michael Sieweke, Alexander-von-Humboldt-Professor an der TU Dresden.
Der Zellkulturschock
Das Team um Prof. Sieweke am Zentrum für Regenerative Therapien Dresden (CRTD) der TU Dresden und dem Center of Immunology Marseille Luminy (CNRS, INSERM, Aix-Marseille University) untersuchte in der Maus Lungenmakrophagen, Immunzellen, die eigentlich in den Lungenbläschen leben. Dem Team gelang es, die Zellen unter Laborbedingungen über mehrere Monate und in großer Zahl zu vermehren. Obwohl ihr Aussehen und ihre allgemeinen Eigenschaften gleichblieben, hatten sie bei näherer Betrachtung aber viele Eigenschaften verändert, um sich an die Kulturbedingungen im Labor anzupassen.
„Jede Zelle in unserem Körper hat den gleichen Satz von Genen, aber die Zellen unterscheiden sich darin, welche Gene eingeschaltet und welche ausgeschaltet sind. Man kann sich das wie einen molekularen Fingerabdruck der Zelle vorstellen - eine einzigartige Kombination von eingeschalteten Genen, die z. B. einen Lungenmakrophagen von einem Darmmakrophagen und einer Gehirnzelle unterscheiden", sagt Sethuraman Subramanian, Erstautor der Studie. Die Forschenden haben das Genexpressionsmuster der im Labor gezüchteten Zellen mit den entsprechenden Zellen aus der Lunge verglichen und dabei erhebliche Unterschiede festgestellt. „Dies war zu erwarten. Auf einer Plastikoberfläche zu leben und alle Nährstoffe zur Verfügung zu haben, ist etwas ganz anderes als die natürlichen Bedingungen im Körper. Die Zellen mussten sich an die neuen Bedingungen gewöhnen und taten dies, indem sie die Aktivitätsstatus von mehr als 3.000 Genen änderten. Die Frage, die uns wirklich interessierte, war jedoch, ob diese Veränderungen umkehrbar sind", erklärt Prof. Sieweke.
Das Vergessen der Kultur
Das Team transferierte die im Labor gezüchteten Makrophagen zurück in ihre natürliche Umgebung in der Mauslunge. Detaillierte Vergleiche zeigten, dass die im Labor gezüchteten Zellen nicht von ihren Äquivalenten, die die Lunge nie verlassen hatten, zu unterscheiden waren. „Wir waren sehr überrascht zu sehen, dass die großen Anpassungen an die Kulturbedingungen im Labor, die die Makrophagen vorgenommen hatten, sich als vollständig reversibel erwiesen. Die Makrophagen hatten ihre Laborerfahrung vollkommen ‚vergessen‘ und nahmen ihre normale Funktion und ihre normale Genaktivität in der Lunge vollständig wieder auf, ohne Beeinträchtigung oder Erinnerung an den vorherigen Kulturschock", sagt Clara Busch, ebenfalls Erstautor der Studie.
Zelltherapien der Zukunft
Obwohl die Forschung an Mäusen durchgeführt wurde, eröffnet sie vielversprechende Aussichten für Therapien beim Menschen. Die Fähigkeit, Makrophagen zwischen Zellkulturen und ihrer natürlichen Umgebung zu transferieren, hat ein großes Potenzial für künftige makrophagenbasierte Zelltherapien. Lungenmakrophagen könnten so im Labor vermehrt und experimentell auf die Bekämpfung bestimmter Krankheiten zugeschnitten werden, bevor sie in die Lunge des Patienten gebracht werden, wo sie dann sofort ihre Funktion erfüllen können. Ein solches System könnte zur Behandlung von Krebs, fibrotischen Erkrankungen oder Infektionen in der Lunge wie bei COVID-19 eingesetzt werden. Mittelfristig könnte dies auch für andere Organe möglich sein.
„Diese Studie begann lange vor dem Ausbruch der Pandemie, zeigt aber einmal mehr, dass Grundlagenforschung, als Quelle für künftige therapeutische Anwendungen dienen kann", schließt Prof. Sieweke.
Über Prof. Michael Sieweke
Die Forschungsgruppe von Prof. Michael Sieweke arbeitet an der Schnittstelle von Immunologie und Stammzellforschung. Die Forschenden konzentrieren sich auf die Untersuchung von hämatopoetischen Stammzellen und Makrophagen, langlebige Zellen des Immunsystems, die eine wichtige Rolle bei der Geweberegeneration erfüllen. 2018 erhielt Prof. Michael Sieweke den höchstdotierten Forschungspreis in Deutschland - die Alexander-von-Humboldt-Professur, die internationale Spitzenforscher an deutsche Universitäten holt. Außerdem erhielt er ein European Research Council Advanced Grant. Er ist auch Projektleiter bei SaxoCell, einem vom Bundesministerium für Bildung und Forschung (BMBF) geförderten Clusters4Future Forschungscluster zur Zelltherapie. Prof. Sieweke ist nun stellvertretender Direktor am Zentrum für Regenerative Therapien der TU Dresden (CRTD).
Originalveröffentlichung
Sethuraman Subramanian, Clara Jana-Lui Busch, Kaaweh Molawi, Laufey Geirsdottir, Julien Maurizio, Stephanie Vargas-Aguilar, Hassiba Belahbib, Gregory Gimenez, Ridzky, Anis Advent Yuda, Michaela Burkon, Jérémy Favret, Sara Gholamhosseinian Najjar, Bérengère de Laval, Prashanth Kumar Kandalla, Sandrine Sarrazin, Lena Alexopoulou and Michael H. Sieweke: Long-term culture expanded alveolar macrophages restore full epigenetic identity in vivo, Nature Immunology (February 2022)
Link: https://www.nature.com/articles/s41590-022-01146-w
Über das Zentrum für Regenerative Therapien Dresden (CRTD)
Am Zentrum für Regenerative Therapien Dresden (CRTD) der TU Dresden widmen sich Spitzenforscher und -forscherinnen aus mehr als 30 Ländern neuen Therapieansätzen. Sie entschlüsseln die Prinzipien der Zell- und Geweberegeneration und ergründen deren Nutzung für Diagnose, Behandlung und Heilung von Krankheiten. Das CRTD verknüpft Labor und Klinik, vernetzt Wissenschaft und Klinik, nutzt Fachwissen in Stammzellforschung, Entwicklungs- und Regenerationsbiologie, um letztlich die Heilung von Erkrankungen wie Alzheimer und Parkinson, hämatologischen Krankheiten wie Leukämie, Stoffwechselerkrankungen wie Diabetes sowie Augen- Lungen- und Knochenerkrankungen zu erreichen.
Das CRTD wurde 2006 als Forschungszentrum der Deutschen Forschungsgemeinschaft (DFG) gegründet und bis 2018 als DFG-Forschungszentrum, als auch Exzellenzcluster gefördert. Seit 2019 wird das CRTD mit Mitteln der TU Dresden und des Freistaates Sachsen finanziert.
Das CRTD ist eines von drei Instituten der zentralen wissenschaftlichen Einrichtung Center for Molecular and Cellular Bioengineering (CMCB) der TU Dresden.
Web: www.tu-dresden.de/cmcb/crtd
Web: www.tu-dresden.de/cmcb
Medienkontakt:
Dr. Magdalena Gonciarz
PR Officer
Center for Molecular and Cellular Bioengineering (CMCB)
Tel.: +49 351 458-82065
Wissenschaftlicher Ansprechpartner:
Prof. Michael H. Sieweke,
Alexander von Humboldt Professor
Center for Regenerative Therapies Dresden (CRTD)
Tel.: +49 351 458-82200
Zusätzliche Materialien:
Website der Forschungsgruppe von Prof. Dr. Michael Sieweke: https://tud.link/3j2h
Bildmaterial: https://tud.link/wzt0
