May 10, 2023
IT TAKES TWO TO TANGO - ICA512 CONDENSATION WITH INSULIN IN SORTING AND TRANSIT TO SECRETORY GRANULE
ICA512 or IA-2, also known as the type1 diabetes autoantigen is an intrinsic granule protein, involved in the regulation of biosynthesis and turnover of insulin secretory granules in pancreatic islet beta cells. The depletion of ICA512/IA-2 from the beta cells results in reduction of the insulin secretory granule stores. Now, researchers from the Paul Langerhans Institute Dresden have teamed up with scientists from the laboratory of Prof. Dr. Mario Ermácora at the Universidad Nacional de Quilmes in Argentina to investigate the molecular basis of the regulated sorting in pancreatic islet beta cells. The outcome of this study was now published in the renowned journal “Protein Science”.
ICA512/IA-2 and phogrin/IA-2beta are multidomain receptor-type protein-tyrosine phosphatases. Both proteins are expressed in beta cells and other peptide-secreting neuroendocrine cells, where they are enriched in the membrane of secretory granules (SGs). In pancreatic beta cells ICA512 and phogrin are involved in the biogenesis and turnover of insulin SGs and their depletion, either alone or in combination leads to the reduction of the intracellular insulin SG stores.
ICA512 consists of a large luminal region, a single-pass transmembrane region and a cytoplasmic domain. Interestingly, the N-terminal luminal segment of ICA512 (and also that of phogrin) comprises a region similar to another protein entitled Regulated endocrine specific protein, Resp18. Both ICA512 and Resp18 expression are increased in conditions stimulating SG biogenesis in beta cells, such as the stimulus by high glucose.
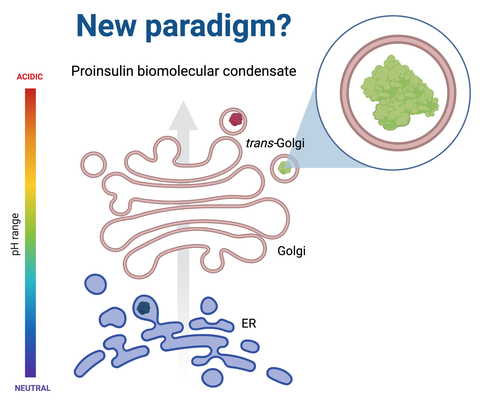
“Our exciting, long term scientific collaboration with the laboratory of Prof. Dr. Mario Ermácora has been with the focus on structure-to-function oriented investigations on the role of ICA512 luminal region. More specifically we have been interested in the function of the segment of ICA512, ICA512 RESP18 homology domain similar to Resp18 – a unique segment in three proteins, namely Resp18, ICA512 and phogrin – in the formation of nanoscale condensates. We have shown that ICA512 RESP18 homology domain provides potential means for the characteristic progressive pH dependent maturation of SGs through co-condensation with the insulin along the secretory pathway in beta cells”, explains Juha Torkko, senior scientist at the Paul Langerhans Institute of Helmholtz Munich at the University Hospital and Faculty of Medicine Carl Gustav Carus of TU Dresden, who was involved in the study as a co-investigator. “The current work extended the findings of our previous work, as it was shown that ICA512 luminar RESP18 segment co-condensates both proinsulin and insulin, which suggests mechanism with synergy to sort the two proteins early at the endoplasmic reticulum and to be destined to mature membrane-bound insulin SG.”
The conducted study showed for the first time that proinsulin nanoscale self-condensation occurs at close to neutral pH similar to the early secretory pathway compartments the ER and Golgi. The intrinsic ability of proinsulin to form condensates shown by the study implies a key role for chaperoning proteins for coordinated folding versus condensation at close to neutral pH and until disulphide bond formation and ER exit to drive insulin SG biogenesis in beta cells.
“Impairments in the amount of synthesized proinsulin has been associated to both type 1 and type 2 diabetes. Better understanding of the factors that are required for insulin biosynthesis, and that are intrinsic for the proper folding and function of proinsulin provide eventually new insight to the pathogenesis of all different types of diabetes”, finalizes Prof. Dr. Michele Solimena, one of the senior authors of the study and director of the Paul Langerhans Institute of Helmholtz Munich at the University Hospital and Faculty of Medicine Carl Gustav Carus of TU Dresden.
Original publication:
Toledo PL, Vazquez DS, Gianotti AR, Abate MB, Wegbrod C, Torkko JM, Solimena M, Ermácora MR. Condensation of the β-cell secretory granule luminal cargoes pro/insulin and ICA512 RESP18 homology domain. Protein Sci. 2023 May 9. doi: 10.1002/pro.4649.