17.09.2019
Internationales Forschungsteam identifiziert neuen wichtigen Faktor für die Insulin-Homöostase
Dresden und Victoria, 17. September 2019
Forscher der australischen La Trobe University und des Paul-Langerhans-Instituts Dresden, Partner im Deutschen Zentrum für Diabetesforschung (DZD e.V.), haben festgestellt, dass das Protein Atp6ap2 für die ordnungsgemäße Funktion von pankreatischen Betazellen unerlässlich ist. Deaktivierten die Wissenschaftler dieses Protein in Betazellen von Mäusen, stieg deren Blutzuckerspiegel dramatisch an. Die Ergebnisse dieses internationalen Forschungsprojektes, zu dem auch Wissenschaftler des Max-Delbrück-Centrum für Molekulare Medizin in Berlin beigetragen haben, wurden nun in der renommierten Zeitschrift "Proceedings of the National Academy of Sciences of the United States of America (PNAS)" veröffentlicht.
Jeder elfte Erwachsene weltweit leidet an Diabetes, und die Zahl der Diabetespatienten steigt rasant. Menschen mit Typ-1-Diabetes fehlt Insulin, das Hormon, welches den Blutzuckerspiegel reguliert. Insulin wird von spezialisierten Zellen in der Bauchspeicheldrüse, den sogenannten Betazellen, produziert. Wenn diese Zellen ihre Funktion verlieren oder versehentlich zerstört werden, verliert der Körper seine Fähigkeit, Insulin herzustellen, wodurch Diabetes und der lebenslange Bedarf des Patienten an Insulininjektionen entsteht.
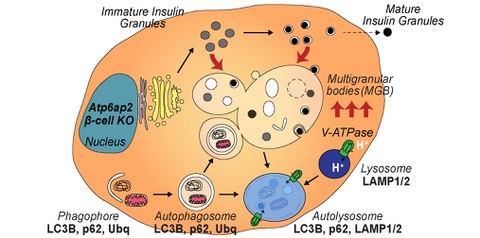
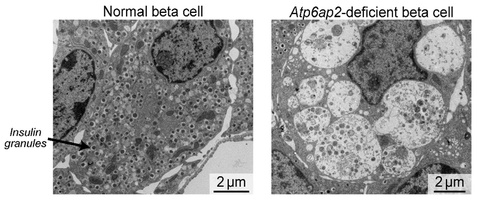
Wissenschaftler der La Trobe University im australischen Victoria und des Paul-Langerhans-Instituts Dresden (PLID) haben festgestellt, dass ein Protein namens Atp6ap2 für die ordnungsgemäße Funktionalität von Betazellen unerlässlich ist. "Als wir dieses Protein in den Betazellen von Mäusen inaktiviert haben, stieg deren Blutzuckerspiegel dramatisch an", erklärt Dr. Katrina Binger, Dozentin am Institut für Biochemie und Genetik der Universität La Trobe und Erstautorin der Studie. "Bei näherer Betrachtung stellten wir fest, dass Atp6ap2-defiziente Betazellen mit großen Blasen oder "Vesikeln" gefüllt waren, welche zu einem Insulinverlust in diesen Zellen und zur Entstehung von Typ-1-Diabetes führten."
Um den Grund für diese anormale Blasenbildung zu entschlüsseln, verwendeten die Wissenschaftler innovative bildgebende Verfahren, um ihren Ursprung zu bestimmen und ihre Acidität zu messen. „Obwohl Atp6ap2 als Untereinheit der Protonenpumpe, welche die Acidität herstellt, bekannt ist, konnten wir nach Atp6ap2-Inaktivierung keinerlei Beeinträchtigung der Acidität erkennen“ ergänzt Martin Neukam, ebenfalls Erstautor und Postdoc im Solimena Labor des PLID. Die Analysen zeigten, dass die Entfernung von Atp6ap2 zu einer Art Verstopfung bei der Entfernung von zellulären Abfallprodukten führt, was darauf hindeutet, dass Atp6ap2 für den Transport von Vesikeln und/oder insulinhaltigen Granula innerhalb von Betazellen erforderlich ist. Seine Abwesenheit verursacht demnach die Anhäufung von Abfallprodukten und das anormale Wachstum der Blasen. "Basierend auf diesen Erkenntnissen sind wir nun neugierig zu erfahren, mit welchen Molekülen Atp6ap2 innerhalb von Betazellen interagiert, da dies weitere Erkenntnisse über die Ursachen des Betazellversagens bei der Diabeteserkrankung liefern könnte", sagt Prof. Dr. Andreas Birkenfeld, Senior-Autor der Studie vom Universitätsstudienzentrum für Stoffwechselerkrankungen am Universitätsklinikum Dresden und Forschungsgruppenleiter am Paul Langerhans Institut Dresden des Helmholtz-Zentrums München am Universitätsklinikum und der Medizinischen Fakultät Carl Gustav Carus der TU Dresden.
Atp6ap2 ist auch bekannt als (Pro)renin-Rezeptor, welcher erst vor wenigen Jahren im Mittelpunkt der Herz-Kreislauf-Forschung stand, und als potentielles Medikamenten-Target für Bluthochdruck diskutiert wurde. In der Zwischenzeit konnten jedoch Studien zeigen, dass Atp6ap2 für das reibungslose Funktion vieler verschiedener Zelltypen unerlässlich ist. Dr. Binger kommt zu dem Schluss: "Unsere Studie trägt zu einer wachsenden Zahl an Erkenntnissen bei, dass Atp6ap2 für die korrekte Funktion unserer Zellen wichtig ist. Dies können wir auch hier in Betazellen sehen, welche ohne dieses Protein nicht funktionieren, und es so zum Ausbruch von Typ-1-Diabetes kommt. Es ist daher einfach zu gefährlich, es zu blockieren."
Originalpublikation:
Binger KJ, Neukam M, Tattikota SG, Qadri F, Puchkov D, Willmes DM, Wurmsee S, Geisberger S, Dechend R, Raile K, Kurth T, Nguyen G, Poy MN, Solimena M, Muller DM, Birkenfeld AL. Atp6ap2 deletion causes extensive vacuolation that consumes the insulin content of pancreatic β-cells.
Link: https://www.pnas.org/content/early/2019/09/12/1903678116
Kontakte:
Dr. Katrina Binger
Department of Biochemistry and Genetics
La Trobe Institute for Molecular Sciences (LIMS)
La Trobe University, Bundoora, Victoria 3086, Australia
Phone: +61 3 9479 1350
E-mail: k.binger@latrobe.edu.au
Internet: https://scholars.latrobe.edu.au/display/kbinger
Prof. Andreas Birkenfeld
University Study Center of Metabolic Diseases, Medical Clinic III, Medical Faculty of the TU Dresden, University Hospital Carl Gustav Carus Dresden
Paul Langerhans Institute Dresden at the Helmholtz Zentrum München and the University Hospital and Medical Faculty Carl Gustav Carus at TU Dresden
Fetscherstraße 74
01307 Dresden
Germany
Phone: +49(0)351 458 3651
Fax: +49 (0)351 458 3652
e-mail: andreas.birkenfeld@uniklinikum-dresden.de
Internet: https://tu-dresden.de/med/mf/plid/forschung/Birkenfeld