06.09.2019
Metabolisch phänotypisierte Patienten stellen eine neue und komplementäre Quelle von Pankreasgewebe für die Diabetesforschung dar
Die aktuelle Forschung zur Betazellbiologie im Zusammenhang mit Typ-2-Diabetes basiert hauptsächlich auf der langjährigen Technik zur Isolation der pankreatischen Langerhans´schen Inseln. Dieses Verfahren, bei dem Enzyme zur Separation der endokrinen Inseln aus dem umgebenden exokrinen Gewebe verwendet werden, kann zu unerwünschten Effekten auf die ersteren führen. Wissenschaftler des Paul-Langerhans-Instituts Dresden entwickelten einen neuen Ansatz zur Isolation von Inseln aus schockgefrorenen chirurgischen Proben, die von metabolisch phänotypisierten pankreatektomierten Patienten gespendet wurden. Ein neuer Übersichtsartikel in der Zeitschrift "Molecular Metabolism" erklärt nun, wie diese Plattform einen Paradigmenwechsel für die Erforschung von menschlichen Langerhans´schen Inseln und der Diabetesforschung darstellen kann.
Typ-2-Diabetes mellitus betrifft Millionen von Menschen weltweit und stellt ein wachsendes Gesundheitsproblem, eine zunehmende Belastung für die Lebenserwartung und -qualität der Patienten sowie eine zunehmende Herausforderung für die Gesundheitssysteme dar. Definierendes Merkmal dieser Krankheit ist das funktionelle Versagen von Betazellen, welches in den letzten Jahrzehnten intensiv, vor allem mit enzymatisch isolierten primären Inselzellen als Modellsystem, untersucht wurde. Das Aufkommen von Hochdurchsatz "-omics"-Ansätzen hat jedoch unsere Möglichkeiten, subtile Veränderungen in Biomolekülen zu messen, dramatisch verbessert. So ist es mittlerweile möglich geworden, diese Technologien auf chirurgische Proben als experimentelle Modelle anzuwenden, um Betazellen in situ und damit in einem Kontext zu untersuchen, der ihren natürlichen Zustand in vivo möglichst nahe kommt.
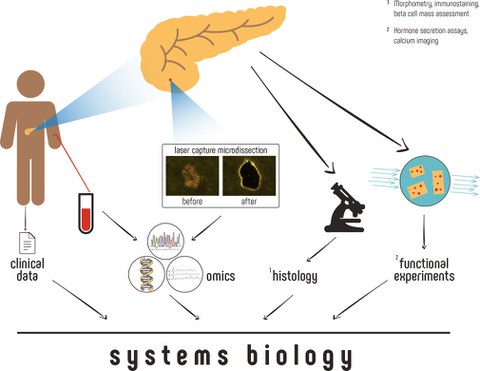
"In unserem Review diskutieren und präsentieren wir einen Ansatz für die Gewinnung von Inselgewebe mit höchster Reinheit aus einer begrenzten Menge Ausgangsmaterial, welches für praktisch alle nachgelagerten "-omics"-Anwendungen verwendet werden kann. Unser Ansatz basiert auf dem so genannten Laser Capture Microdissection-Verfahren (LCM), bei dem mit einem Laserstrahl die gewünschten endokrinen Zellen physikalisch aus dem umgebenden Gewebe ausgeschnitten werden", erklärt Marko Barovic, Doktorand im Solimena Labor des Paul-Langerhans-Instituts Dresden und Erstautor der Studie. Mit Hilfe der LCM-Technik können pankreatische Inseln aus nur wenigen hundert Mikrogramm Pankreasgewebe isoliert werden, welches bei der routinemäßigen Bearbeitung von chirurgischen Patientenproben während einer Pankreasoperation gewonnen wird. Dieses Verfahren hat den besonderen Vorteil, dass er in praktisch jedem akademischen Krankenhaus oder Forschungszentrum anwendbar ist, welches Pankreatektomien durchführt. Dadurch lässt sich die Anzahl der Proben, die bundesweit entnommen werden können, massiv erhöht. Das Schockfrosten des Gewebes direkt nach der Explantation verhindert darüber hinaus eine weitere Veränderung des biologischen Materials und ermöglicht so die anschließende Untersuchung von zellulären Parametern wie mRNA- oder Proteingehalten in einem Zustand, der nahezu identisch mit dem innerhalb des menschlichen Körper ist. "Ein weiterer und sehr wertvoller Vorteil unseres Ansatzes ist außerdem der Zugang zu allen relevanten klinischen Informationen des Patienten sowie die Möglichkeit unmittelbar vor der Operation einen Glukosetoleranztests durchzuführen, um eine genaue metabolische Phänotypisierung des Spenders zu gewährleisten. Damit haben wir erstmals die Möglichkeit, klinische Daten mit einem detaillierten "-omics"-Profiling zu kombinieren und so die beobachteten Veränderungen in Bezug auf Dauer und Verlauf der Diabeteserkrankung zu verfolgen", fasst Barovic zusammen.
Die im Review vorgestellten Methoden werden derzeit aktiv innerhalb der Zusammenarbeit des IMI-Konsortiums RHAPSODY eingesetzt, um einen umfassenden Einblick in die molekularen Eigenschaften der Diabeteserkrankung auf europäischer Ebene zu ermöglichen.
Originalpublikation:
Barovic M, Distler M, Schöniger E, Radisch N, Aust D, Weitz J, Ibberson M, Schulte AD, Solimena M. Metabolically phenotyped pancreatectomized patients as living donors for the study of islets in health and diabetes. Mol Metab. 2019 Sep;27S:S1-S6. doi: 10.1016/j.molmet.2019.06.006. Review.
https://www.sciencedirect.com/science/article/pii/S2212877819305678