Endozytose und Systembiologie
Die Endozytose, d.h. die Aufnahme von Signal- und Nährstoffmolekülen in eine biologische Zelle und deren intrazellulärer Transport, stellt einen zentralen Mechanismus der Signalverarbeitung dar. Die Details der Interaktionen zwischen den intrazellulären Transportcontainern, Endosomen genannt, sind jedoch noch weitgehend ungeklärt. Die schnelle Bewegung der Endosomen, deren geringe Größe, große Anzahl und die intrinsische stochastische Natur der Endosominteraktionen bereiten fundamentale Probleme bei der Auswertung von Mikroskopiedaten der Endozytose.
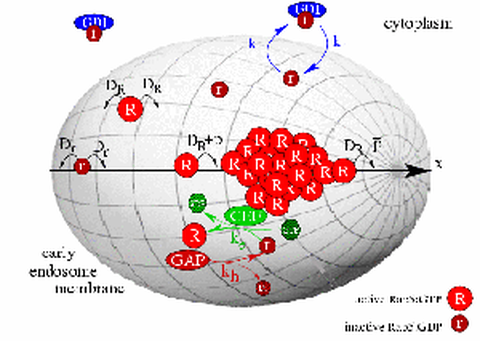
Zusammen mit unseren Partnern studieren wir die Regulation der Rab-GTPasen (Abbildung) als Schaltzentrale der Endosominteraktionen und die 2-parametrische Verteilung von Endosomgröße und Endosomtransportgut als Resultat der Interaktionen. Um von den zeitabhängigen Daten von HeLa-Zellen und Leberzellen auf die zu Grunde liegenden Mechanismen schließen zu können, nutzen wir ein Agenten-basiertes Modell (ABM), in dem Endosombiogenese, Endosomfusion, Endosomspaltung und Endosomumwandlung über eine virtuelle Population von Endosomen repräsentiert und über stochastische Prozesse aktualisiert werden.
Partner
- Max-Planck-Institut für Physik komplexer Systeme, Dresden
- Max-Planck-Institut für Molekulare Zellbiologie und Genetik, Dresden
ZIH-Kontakt
Laufzeit
06/2008 - 03/2015
Förderung
BMBF
Publikationen
- A.P. Kupinski, I. Raabe, M. Michel, D. Ail, L. Brusch, T. Weidemann, C. Bökel. Phosphorylation of the Smo tail is controlled by membrane localization and is dispensable for clustering. J. Cell Sci., 126, 20, 4684-4697, 2013. [Link]
- L. Foret, J.E. Dawson, R. Villaseñor, C. Collinet, A. Deutsch, L. Brusch, M. Zerial, Y. Kalaidzidis, F. Jülicher. A general theoretical framework to infer endosomal network dynamics from quantitative image analysis. Curr. Biol., 22, 15, 1381 - 1390, 2012. [Link]
- T. Nakakuki, M. R. Birtwistle, Y. Saeki, N. Yumoto, K. Ide, T. Nagashima, L. Brusch, B. A. Ogunnaike, M. Okada-Hatakeyama, B. N. Kholodenko. Ligand-specific c-Fos expression emerges from the spatiotemporal control of ErbB network dynamics. Cell, 141, 884-896, 2010. [Link]
- P. del Conte-Zerial, L. Brusch, J. Rink, C. Collinet, Y. Kalaidzidis, M. Zerial, A. Deutsch. Membrane identity and GTPase cascades regulated by toggle and cut-out switches. Mol. Syst. Biol., 4, 206, 2008. [Link]
- L. Brusch, A. Deutsch. The coherence of the vesicle theory of protein secretion. J. Theor. Biol., 252, 370-373, 2008. [Link]