28.07.2022
Neue Studie zeigt, wie 'freie Radikale' die Zellteilung vorantreiben, und eröffnet damit einen neuen Weg zur Krebstherapie
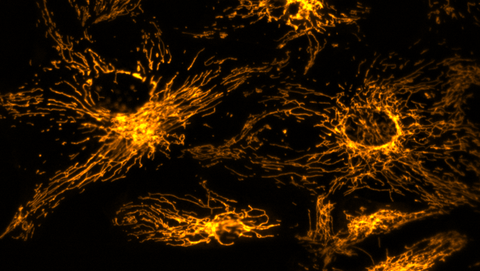
Pigmentepithelzellen der Netzhaut: die reaktiven Sauerstoffspezies sind orange gefärbt
Wissenschaftler:innen entdeckten, wie natürlich vorkommende, aber instabile Moleküle, so genannte freie Radikale, den grundlegenden Prozess der Zellteilung steuern können, der, wenn er schief läuft, zu unkontrolliertem Zellwachstum und Krebs führen kann.
In der neuen Studie zeigen die Forschenden, dass das aus freien Sauerstoff Radikalen entstehende Wasserstoffperoxid die Cyclin-dependent Kinase 2, auch CDK2 genannt, aktiviert. CDK2 ist ein Schlüsselprotein der Zellteilung dessen Oxidation über einen bisher unbekannten Mechanismus die Zellteilung fördert. Diese Erkenntnisse belegen, dass freie Radikale und Wasserstoffperoxid bei der Zellteilung eine wichtige Rolle spielen, und eröffnen einen potenziellen neuen Weg zur Bekämpfung zahlreicher Krebsarten, die mit einer gestörten CDK2-Aktivität einhergehen.
Ein wichtiges Signalmolekül
Reaktive Sauerstoffspezies sind sehr instabile, sauerstoffhaltige Moleküle, die leicht mit anderen Molekülen in der Zelle reagieren können. Sie werden von den Mitochondrien, den Kraftwerken der Zelle, bei der Energiegewinnung aus Kohlenhydraten als Nebenprodukt der Zellatmung erzeugt.
Freie Radikale, wie z. B. reaktive Sauerstoffspezies, wurden zunächst als schädliche Substanzen erkannt, die vorallem Proteine aber auch Fettsäuren und DNA durch Oxidation schädigen. In den letzten Jahren wurden sie jedoch als wichtige Signalmoleküle identifiziert, die in der richtigen Konzentration die Zellteilung anregen können.
Wissenschaftler:innen des Institute of Cancer Research (ICR) in London und des Biotechnologischen Zentrums (BIOTEC) der TU Dresden untersuchten mit modernsten genetischen und metabolischen Methoden in menschlichen Pigmentepithelzellen der Netzhaut, wo und wann freie Radikale während der Zellteilung entstehen.
Krebszellen benötigen freie Radikale, um Aspekte der Tumorentwicklung und des Fortschreitens des Tumors zu fördern. Daher ist das Verständnis ihrer Rolle bei der Zellteilung von großer medizinischer Bedeutung.
Antrieb der Zellteilung
Das Forschungsteam fand heraus, dass die Produktion freier Radikale mit der Aktivität der Mitochondrien korreliert und in verschiedenen Phasen der Zellteilung zunimmt. Das Team zeigte, dass eine Verringerung der freien Radikale mittels Antioxidantien bzw. gezielten Stoffwechselmanipulation die normale Zellteilung störte und die Verdopplung des Genoms, auch DNA-Replikation genannt, verlangsamte.
Insbesondere beobachteten sie, dass der Gehalt an freien Radikalen die Aktivität des Schlüsselproteins CDK2 widerspiegelte, welches für die DNA-Replikation während der Zellteilung erforderlich ist. Dies veranlasste sie, den Zusammenhang zwischen freien Radikalen und CDK2 weiter zu untersuchen.
Die Forschungsarbeit, die in der Fachzeitschrift Developmental Cell veröffentlicht und vor kurzem von Nature Reviews Molecular Cell Biology als Forschungshighlight ausgewählt wurde, wurde größtenteils vom Europäischen Forschungsrat (ERC) finanziert. Zusätzliche Mittel zur Durchführung der Arbeiten wurden vom ICR, das sowohl ein Forschungsinstitut als auch eine Stiftung zur Krebsbekämpfung ist, sowie durch das „Radiation Research Network“ (RadNet) des „Cancer Research UK“ zur Verfügung gestellt.
Freie Radikale entstehen auch bei der Strahlentherapie und können bei ausreichender Konzentration für den Krebs schädlich sein. Viele Krebszellen weisen einen erhöhten Gehalt an freien Radikalen auf und sichern ihr Überleben, indem sie eigene Antioxidantien produzieren. Damit begrenzen Krebszellen den Gehalt an potenziell schädlichen Molekülen, reizen aber gleichzeitig auch ihre Fähigkeit weiteren freien Radikalen zu widerstehen aus. Daher ist die Strahlentherapie ein wirksames Mittel, um den oxidativen Stress in Krebszellen zu erhöhen und damit das Gleichgewicht zu Gunsten des Zelltods zu verschieben.
Ein neuartiger Weg, um CDK2 anzugehen
Aufgrund seiner entscheidenden Rolle bei der Zellteilung ist CDK2 seit langem ein Ziel für die Krebstherapie. Bisher sind viele Versuche unternommen worden, einen Hemmstoff gegen CDK2 zu entwickeln der die DNA-Replikation in Krebszellen zu hemmt. Da es in Menschen und Säugetieren noch andere wichtige Proteine gibt, die CDK2 sehr ähnlich sind, konnte bisher noch kein Wirkstoff entwickelt werden, der spezifisch für CDK2 ist und keine starken Nebenwirkungen hat.
Mithilfe verschiedener genetischer Instrumente und zellbiologischer Techniken entdeckte das Team, dass Wasserstoffperoxid CDK2 an einer bestimmten Stelle oxidieren muss, um seine Aktivität und Funktion für die DNA-Replikation aufrechtzuerhalten. Entscheidend ist, dass diese neu entdeckte Stelle einzigartig für das CDK2-Protein ist und nicht bei CDK2-ähnlichen Proteinen zu finden ist.
Die Ergebnisse dieser Studie stellen daher ein mögliches neues therapeutisches Ziel für die Entdeckung von Medikamenten gegen CDK2 dar und eröffnen neue Forschungsmöglichkeiten für eine wirksamere Behandlung bestimmter Krebsarten.
Ein simpler und eleganter Mechanismus
„Unsere Studie identifiziert einen einfachen aber eleganten Mechanismus, der die Zellteilung mit dem Prozess der Energiegewinnung in der Zelle verbindet. Frühere Studien zu diesem Thema hatten gezeigt, dass die richtige Konzentration von reaktiven Sauerstoffspezies die Zellteilung fördern können. Bis jetzt war aber unklar, wie dies geschieht", sagt Studienleiter Dr. Jörg Mansfeld, Leiter des Teams für posttranslationale Modifikationen und Zellproliferation am ICR, der diese Forschung zuvor am Biotechnologischen Zentrum (BIOTEC) der TU Dresden geleitet hat.
"Unsere Ergebnisse zeigen zum ersten Mal, dass ein Schlüsselprotein der Zellteilung, CDK2, direkt durch freie Radikale, die von den Mitochondrien während des Energieerzeugungsprozesses in der Zelle produziert werden, reguliert werden kann. Wir haben den Zusammenhang zwischen reaktives Sauerstoffmolekülen und Zellteilung in verschiedenen Zelltypen, einschließlich Brustkrebszellen, untersucht und festgestellt, dass CDK2 in all diesen Situationen oxidiert werden kann. Dies weist auf eine wichtige Bedeutung dieses Prozesses hin."
"Die Entdeckung der CDK2-Oxidationsstelle eröffnet auch neuartige Möglichkeiten das Protein gezielt anzugreifen. CDK2-Oxidation könnte zur Entwicklung einer neuen Klasse von CDK2-spezifischen Hemmstoffen genutzt werden, die nicht auf eng verwandte CDK2-artige Kinasen abzielen. Es gibt Hinweise darauf, dass die Hemmung von CDK2 bei bestimmten Krebsarten wie Eierstockkrebs, MYCN-amplifiziertem Neuroblastom und KRAS-mutiertem Lungenkrebs möglicherweise sehr wirksam sein könnte“.
"Wir untersuchen jetzt auch, ob die bei der Strahlentherapie entstehenden freien Radikale auch CDK2 oder andere für die Zellteilung erforderliche Schlüsselproteine oxidieren können und ob dies Hinweise gibt, welche Zellen empfindlich bzw. resistent gegen die Behandlung sind."
Wissenschaftlicher Ansprechpartner:
Dr. Jörg Mansfeld
Tel. +44 20 7153 5261
E-mail:
