Lasersystem für die optogenetische Stimulation mit subzellulärer Auflösung zur Untersuchung neuronaler Netzwerke
Die Optogenetik basiert auf dem Einsatz transgener Ionenkanäle und Ionenpumpen, die durch Lichteinstrahlung aktiviert werden können. Sie hat sich zu einem leistungsstarken Instrument in der Zellbiologie entwickelt, um die Aktivität einzelner Neuronen zu steuern und so Netzwerke des zentralen Nervensystems untersuchen zu können. Die bisher verwendeten Beleuchtungstechniken wie Weitfeldbeleuchtung mittels Leuchtdioden oder Laserscanning-Verfahren weisen aber Nachteile auf, da diese nicht die notwendige örtliche Selektivität aufweisen oder sich mehrere Zellen nicht gleichzeitig stimulieren lassen. Eine selektive Adressierung einzelner Zellen mit der Möglichkeit der individuellen zeitlichen Modulation ist bisher kaum möglich.
Dieses Vorhaben hat daher die Realisierung eines universell einsetzbaren digital-optischen Stimulationssystems für die Durchführung von in vitro und in vivo Experimenten in der Optogenetik zum Ziel. Dafür soll das Potential der Wellenfrontformung mittels phasenmodulierender Flächenlichtmodulatoren genutzt werden, um einige der wichtigsten Herausforderungen in der Optogenetik zu lösen: die Stimulation einzelner Zellen mit subzellulärer Auflösung, die gleichzeitige Adressierung mehrerer Zellen oder Zellgruppen sowie die Korrektur optischer Aberrationen. Das System soll zwei Wellenlängen umfassen: eine zur Zellaktivierung (473 nm zur Anregung von Kanalrhodopsin), und eine zur Inhibierung (589 nm zur Anregung von Halorhodopsin). Die Schlüsselkomponenten des Systems bilden ferroelektrische Flüssigkristallmodulatoren zur Darstellung von computergenerierten Hologrammen für eine maßgeschneiderte Wellenfront- und Lichtfeldformung. Mehrere Fokalpunkte können gleichzeitig erzeugt und individuell mit Millisekunden-Zeitauflösung moduliert werden. Die erzeugten Aktionspotentiale sollen mit elektrophysiologischen Techniken wie Patch-Clamp-Elektroden oder Multi-Elektrodenarrays ausgelesen werden. Durch iterative Verfahren sollen sowohl systeminhärente optische Aberration als auch Brechungsindexvariationen durch die biologische Probe selbst minimiert werden, um eine subzelluläre Auflösung zu erreichen.
Es soll eine geschlossene Regelschleife realisiert werden, bei der die Aktionspotentiale eingelesen und in Echtzeit ein aktualisiertes Hologramm errechnet und dargestellt wird. Hierfür ist eine geringe Latenz von etwa 10 ms erforderlich. Als Anwendung sollen sowohl eine örtliche Eigenkalibrierung als auch die Netzwerkuntersuchung mittels trial-by-trial Stimuli erprobt werden.
Das so realisierte System soll eingesetzt werden, um Experimente an neuronalen Netzwerken, die von humanen induzierten pluripotenten Stammzellen ausdifferenziert wurden und Kanalrhodopsin und Halorhodopsin exprimieren, durchzuführen. Dabei sollen insbesondere Untersuchungen der Konnektivität in ungeordneten und gerichteten neuronalen Netzwerken verfolgt werden, um Phänomene der synaptischen Plastizität wie Kurzzeit- oder Langzeit-Potenzierung zu verstehen.
Bearbeiter: F. Schmieder
Zeitraum: 12/18 - 11/21
Partner: Center for Regenerative Therapies Dresden, Dr. R. Habibey, Dr. V. Busskamp
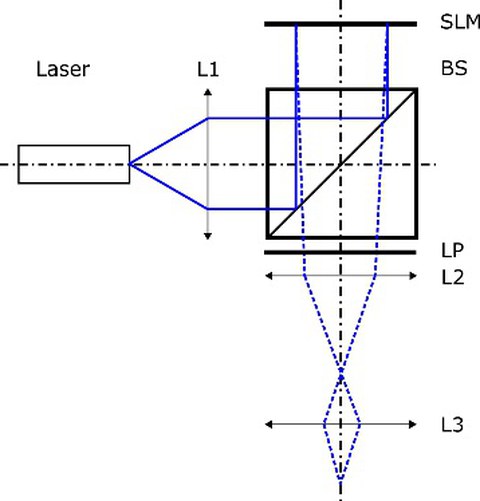
Holographic illumination setup for single cell stimulation
F. Schmieder, S. D. Klapper, N. Koukourakis, V. Busskamp, J. Czarske, "Optogenetic Stimulation of Human Neural Networks Using Fast Ferroelectric Spatial Light Modulator-Based Holographic Illumination", Applied Sciences 8, Special Issue Applications of Digital Holographic Microscopy, 2018
F. Schmieder, M. Henning, L. Büttner, S. Klapper, K. Lenk, V. Busskamp, J. Czarske, “Targeted optogenetic investigation of in vitro human iPSC-derived neuronal networks”, SPIE Photonics West, 27.01.-01.02.2018, San Francisco, USA
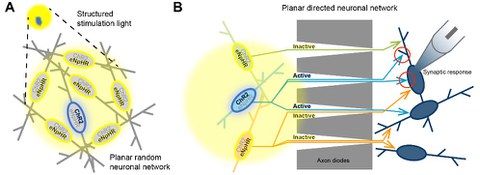
Scheme for network and plasticity analysis in planar random and structured neural networks.
F. Schmieder, L. Büttner, J.W. Czarske, S.D. Klapper, V. Busskamp „ Analysis of connectivity of in vitro human iPSC-derived neuronal networks using holographic illumination”, SPIE Photonics Europe, 22.-26.04.2018, Strasbourg, France
