In ovo-Geschlechtsbestimmung beim Haushuhn (Gallus gallus f. dom.) als Alternative zur routinemäßigen Tötung männlicher Eintagsküken aus Legehennenlinien
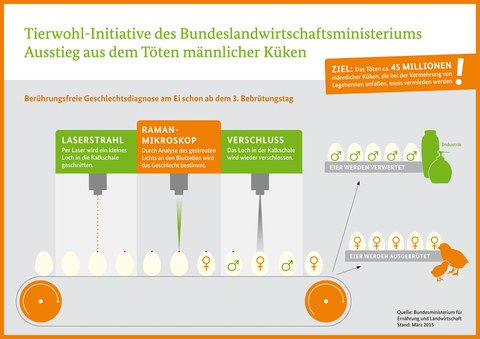
Zurzeit werden allein in Deutschland jährlich ca. 40 Millionen männliche Nachkommen aus Legehennenlinien unmittelbar nach dem Schlupf aussortiert und gemäß der Tierschutz-Schlachtverordnung mittels CO2-Begasung oder im Homogenisator getötet. Die Problematik des Tötens unerwünschter männlicher Eintagsküken betrifft dabei sämtliche Bereiche der Legehennenhaltung, inklusive des Bio-Sektors, stößt jedoch zunehmend auf ethische und rechtliche Bedenken. Praxistaugliche Alternativen zur Merzung der männlichen Eintagsküken standen in der Legehennenvermehrung bislang allerdings nicht zur Verfügung. Unser Forschungsvorhaben hat das Ziel, ein praxistaugliches Verfahren zu entwickeln, welches bereits vor dem Schlupf der Küken eine sichere Geschlechtsbestimmung erlaubt. Dazu soll zukünftig am Tag 3 der Bebrütung, an dem noch kein Schmerzempfinden der Embryos besteht, das Geschlecht optisch spektroskopisch bestimmt werden.
Bei der Ramanspektroskopie wird monochromatisches Licht auf das Untersuchungs-objekt eingestrahlt und das Spektrum des gestreuten Lichtes analysiert. Aus den Banden des Ramanspektrums lässt sich die Struktur von Molekülen eindeutig bestimmen. Nutzt man ultraviolettes (UV) Licht zur Anregung der Ramanstreuung, werden besonders DNA- und Proteininformationen durch den sogenannten Resonanzeffekt verstärkt. Durch Einsatz von energieärmerem Nahinfrarotlicht lässt sich jedoch auch dieses Messprinzip für eine in ovo Geschlechtsbestimmung nutzbar machen. Hierzu wird das Ramanstreulicht von Blut etwa 72 Stunden bebrüteter Embryonen registriert und spektral zerlegt. Die Ramanspektren männlicher Blutzellen weisen gegenüber denen weiblicher Blutzellen geringfügig stärkere Signale im Bereich der Nukleinsäuren auf. Diese Signale differieren signifikant und können somit zur Geschlechtsidentifikation herangezogen werden.
Momentan wird an einer weiteren Erhöhung der Zuverlässigkeit der Geschlechtsbestimmung und einer Optimierung der Schlupfrate gearbeitet. Für den routinemäßigen großindustriellen Einsatz muss die Geschwindigkeit des Verfahrens noch deutlich erhöht werden. Ein weiterer Schwerpunkt der Entwicklung ist die Vollautomatisierung der Selektion. Wir hoffen dieses Ziel bis Mitte 2017 zu erreichen.
Förderung
Bundesministerium für Ernährung und Landwirtschaft
Kooperationen
Prof. Dr. M.-E. Krautwald-Junghanns, PD Dr. T. Bartels, Dr. K. Cramer, Universität Leipzig, Klinik für Vögel und Reptilien
Prof. Dr. R. Preisinger, Dr. A. Förster, Lohmann Tierzucht GmbH
Prof. Dr. F. Kremer, Dr. E.U. Mapesa, Dipl.-Ing. J. Reinmuth, Dipl.-Phys. V. Skokow, Universität Leipzig, Institut für Experimentelle Physik I
Dr. Sven Meißner, Dipl.-Ing. (FH) B. Fischer, EVONTA-Technology GmbH
Kontakt
 © Jonas Golde, KSM
© Jonas Golde, KSM
Herr apl. Prof. Dr. rer. nat. habil. Gerald Steiner
Eine verschlüsselte E-Mail über das SecureMail-Portal versenden (nur für TUD-externe Personen).
Klinisches Sensoring und Monitoring
Klinisches Sensoring und Monitoring
Besuchsadresse:
Medizinisch-Theoretisches Zentrum (MTZ - Haus 91) Fiedlerstraße 42
01307 Dresden