27.06.2024
Neue Studie zeigt, dass die Glukosereaktionen in pankreatischen Betazellen hierarchisch und mit Unterstützung von Vitamin B6 reguliert wird
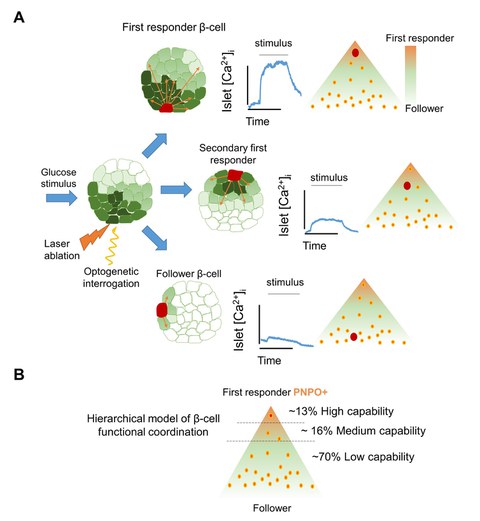
A) Die funktionelle Charakterisierung der Inselkoordination mittels Optogenetik zeigt ein hierarchisches Modell für die Betazellkoordination. Die Koordination umfasst First-Responder-Zellen an der Spitze und Follower-Zellen am unteren Ende. B) First-Responder-Betazellen haben eine höhere Expression des Vitamin-B6-Produktionsenzyms pnpo. Sie können eine Ca2+-Reaktion in vielen Zellen auslösen, während andere Betazellen eine mittlere bis geringe Fähigkeit zur Koaktivierung haben.
Die Koordination der zellulären Aktivität durch Kalzium-Ionen ermöglicht es Betazellen, präzise Mengen an Insulin abzusondern. Ein internationales Forscherteam unter der Leitung von Wissenschaftlern des Paul-Langerhans-Instituts Dresden (PLID) des Deutschen Zentrums für Diabetesforschung setzte nun optogenetische Systeme ein, um im Zebrafischmodell zu untersuchen, wie die Ca2+-Antwort räumlich und zeitlich orchestriert wird und welche Rolle einzelne Betazellen bei der Reaktion auf einen Glukose-Reiz spielen. Diese Studie, die jetzt in der Fachzeitschrift Science Advances veröffentlicht wurde, liefert entscheidende Einblicke in die funktionelle Hierarchie von pankreatischen Betazellen bei der Reaktion auf Glukose und unterstreicht darüber hinaus die Rolle von Vitamin B6 in diesem Prozess. Weiterhin liefert sie ein neues Verständnis dafür, wie Betazellen die Insulinausschüttung koordinieren, einen Schlüsselfaktor bei der Steuerung des Blutzuckerspiegels.
Die Betazellen der Bauchspeicheldrüse regulieren die Glukosehomöostase, indem sie als Reaktion auf die Nährstoffzufuhr Insulin ausschütten. Dabei erfolgt die Insulinfreisetzung in zwei Phasen: zunächst steigt der intrazelluläre Kalzium-Spiegel (Ca2+) und die Insulinfreisetzung schnell an, gefolgt von einer anhaltenden, pulsierenden Insulinsekretion. Bei Personen mit Prädiabetes oder Typ-2-Diabetes (T2D) ist die Sekretion in der ersten Phase beeinträchtigt und in der zweiten Phase reduziert, wobei die Pulsatilität der Sekretion bei T2D ebenfalls verloren geht. Das Verständnis dieser Mechanismen ist daher entscheidend für die Entwicklung wirksamer neuer Diabetes-Therapien.
Für diese Studie hat sich die Forschungsgruppe von Prof. Nikolay Ninov am PLID und dem Zentrum für Regenerative Therapien Dresden (CRTD) der TU Dresden mit Kollegen der Université Libre de Bruxelles und des Imperial College London zusammengetan. Die Wissenschaftler setzten optogenetische Systeme ein, um die Rolle einzelner Betazellen im Zebrafisch zu untersuchen. Dieser innovative Ansatz ermöglichte es dem Team, die Aktivität der Betazellen mit Hilfe von Lasern zu beeinflussen und die daraus resultierenden Auswirkungen auf die Ca2+-Dynamik in den pankreatischen Inseln zu beobachten. Indem sie bestimmte Betazellen gezielt aktivierten oder inaktivierten, konnten sie eine hierarchische Struktur unter den Betazellen feststellen und eine Untergruppe von "First-Responder"-Zellen identifizieren. Das Team fand heraus, dass die Ca2+-Antwort der Inseln geringer ausfiel, wenn die First-Responder-Zellen gehemmt wurden. Umgekehrt wurde die Ca2+-Antwort der Inseln verstärkt, wenn die First-Responder-Zellen selektiv aktiviert wurden. Bemerkenswerterweise sind nur etwa 10 % der Betazellen in einer Insel First-Responder, was darauf hindeutet, dass diese kleine Zellpopulation als Kontrollzentrum für die Regulierung der Aktivität der übrigen Betazellen der Insel dient. Der Name "First-Responder" bezieht sich auf die Fähigkeit dieser Zellen, schneller auf Glukose zu reagieren als der Rest der Betazellen, die sogenannten Follower-Zellen. Je näher eine Betazelle dem First-Responder ist, desto schneller reagiert sie auf Glukose, wodurch eine zelluläre Hierarchie entsteht.
Darüber hinaus wurde in dieser Arbeit zum ersten Mal die Bedeutung von Vitamin B6 in diesem Prozess deutlich. Mit Hilfe des neuen Ca2+-Reporters CaMPARI, einem photokonvertierbaren Protein, das sich in Gegenwart einer hohen Ca2+-Konzentration von grüner in rote Fluoreszenz umwandelt, konnten die Forscher nachweisen, dass First-Responder-Betazellen bestimmte metabolische und molekulare Merkmale zeigen, darunter die Expression des Enzyms Pyridoxamin-5'-phosphat-Oxidase (pnpo), das an der Produktion der metabolisch aktiven Form von Vitamin B6 beteiligt ist. Weitere Experimente bestätigten, dass Vitamin B6 für die koordinierte Ca2+-Antwort auf Glukose sowohl in Zebrafischinseln als auch inInseln der Maus unerlässlich ist. Diese Ergebnisse deuten darauf hin, dass Vitamin B6 eine entscheidende Rolle bei der Aktivierung der Ca2+-Reaktion auf Glukose spielt und dass möglicherweise die Zellen, die als erste reagieren, Vitamin B6 produzieren und an den Rest der Betazellen weitergeben, um deren Aktivität zu regulieren. Diese Erkenntnisse könnten sich auf das Verständnis der Stoffwechselwege auswirken, die die Insulinsekretion vorantreiben, und möglicherweise zur Entwicklung neuer Behandlungsmethoden für Diabetes beitragen.
Die Anwendung innovativer optogenetischer Werkzeuge und intravitaler Mikroskopie in Zebrafischen bot den Forschern einen einzigartigen Vorteil: Sie konnten die Betazellaktivität in einem lebenden Organismus beobachten, ohne die normalen physiologischen Bedingungen zu beeinträchtigen. Dieser Ansatz zeigte, dass First-Responder-Zellen im Vergleich zu anderen Betazellen eine höhere Glukosesensitivität und ein anderes Genexpressionsprofil aufweisen. "Unsere Forschung unterstreicht die Bedeutung der Heterogenität der Betazellen und der Arbeitsteilung innerhalb der Inselzellen", so Nikolay Ninov. "Das Verständnis der spezifischen Rolle der verschiedenen Betazell-Subpopulationen könnte in Zukunft zu gezielteren und wirksameren Therapien für Diabetes führen. Zudem bin ich davon überzeugt, dass die Erkenntnisse aus dieser Studie neue Wege zur Erforschung der Mechanismen der Betazellkoordination und ihrer Rolle bei der Glukosehomöostase eröffnen."
Originalpublikation
Delgadillo-Silva, L. F., Tasöz, E., Singh, S. P., Chawla, P., Georgiadou, E., Gompf, A., Rutter, G. A., & Ninov, N. (2024). Optogenetic β-cell interrogation in vivo reveals a functional hierarchy directing the Ca2+ response to glucose supported by vitamin B6. Sci. Adv. 10, eado4513 (2024)
