Schwerpunkt der Forschungsarbeit
Die Forschung unserer Arbeitsgruppe fokussiert sich auf die Anwendung von patientenspezifischen induzierten pluripotenten Stammzellen (iPS-Zellen) für die Etablierung von in vitro Krankheitsmodellen. Wir verwenden diese Modelle, um die zugrundeliegenden molekularen und pathophysiologischen Mechanismen verschiedener Krankheitsbilder zu untersuchen. Patientenspezifische iPS-Zellen können aus gewöhnlichen Körperzellen (z.B. Hautzellen, Blutzellen) durch die Überexpression spezifischer Transkriptionsfaktoren reprogrammiert werden, was dazu führt, dass die Zellen zwei wichtige Eigenschaften von embryonale Stammzellen ausprägen. Dazu gehören die Fähigkeit der Selbsterneuerung sowie das Differenzierungspotential (Pluripotenz). Die Selbsterneuerung ist eine besondere Form der Proliferation, bei der beide Tochterzellen die gleichen Stammzellfähigkeiten erhalten, wobei die Pluripotenz die Differenzierung in spezialisierte Körperzellen (z.B. Herzzellen, Nervenzellen, Hepatozyten, Muskelzellen) ermöglicht. Patientenspezifische iPS-Zellmodelle können in verschiedenen Gebieten im Bereich der Grundlagenforschung angewendet werden. Wir wollen die neuen Erkenntnisse, die aus unserer biomedizinischen Grundlagenforschung gewonnen werden, für die Entwickelung verbesserter Therapeutika und zur Entwicklung neuer klinischer Behandlungsansätze einsetzen.
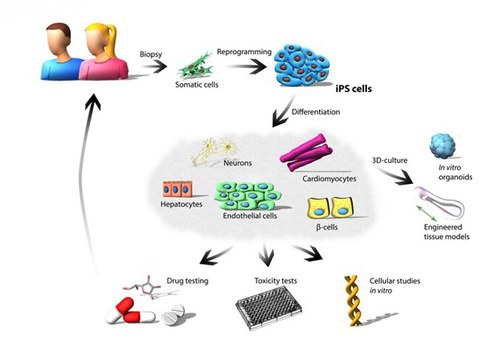
Abb. 1: Anwendung humaner iPS-Zellen. Dargestellt ist die Reprogrammierung somatischer Zellen zu patientenspezifischen iPS-Zellen zur Modellierung und Untersuchung von Erkrankungen in vitro. Die Reprogrammierung der humanen somatischen Zellen erfolgt durch die Überexpression der vier Yamanaka-Faktoren (OCT4, SOX2, KLF4 und c-MYC). Die generierten iPS-Zellen können in diverse Zelltypen differenzieren und ermöglichen die in vitro-Krankheitsmodellierung, Toxizitätsuntersuchungen sowie präklinische Wirkstoff-Screenings.
Themengebiete unserer Forschung
I. Analyse von Entwicklungsprozessen in vitro
Ein wichtiger Themenbereich in der Forschung mit iPS-Zellen ist die Analyse von den komplexen Entwicklungsprozessen in der frühen Embryogenese. Da die in vitro Differenzierung von iPS-Zellen die Prozesse der embryonalen Entwicklung rekapitulieren kann, verwenden wir diese, um die Entwicklungsprozesse der menschlichen frühen Embryogenese auf zellulärer und molekularer Ebene zu untersuchen. Von besonderem Interesse sind dabei die Regulation von bestimmten Schlüsselmolekülen während der frühen Entwicklung des Herzens sowie der Bauchspeicheldrüse.
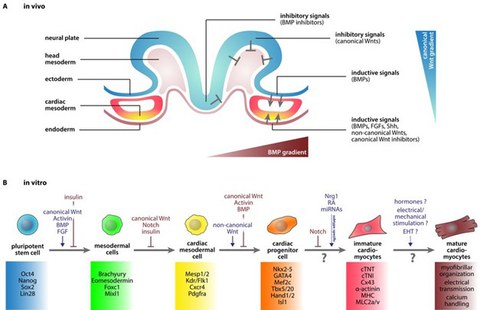
Abb. 2: In vivo und in vitro Kardiogenese. (A) Schematische Darstellung der frühen Embryogenese mit der Signalgebung für die frühe Herzentwicklung in vivo. (B) Kardiale in vitro-Differenzierung von iPS-Zellen zu funktionalen Kardiomyozyten. (Cyganek et al., 2013).
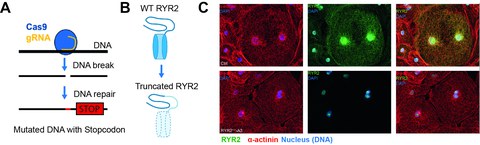
Um weiterhin die Rolle spezifischer Gene während der Entwicklung des Herzens oder in spezifischen Krankheitsbildern besser verstehen und analysieren zu können, verwenden wir CRISPR/Cas9-basierte Geneditierung in unseren iPS-Zellen. So haben wir beispielsweise nachgewiesen, dass ein Knockout des Ryanodin-Rezeptors Typ 2, einem Calciumkanal der für die Exzitations-Kontraktions-Kopplung und somit die Funktion von Kardiomyozyten von kritischer Bedeutung ist, für die Initiierung der Differenzierung von humanen Kardiomyozyten aus iPS-Zellen verzichtbar ist und durch eine gesteigerte Aktivität des IP3R (Inositol-1,4,5-Triphosphat-Rezeptor) kompensiert wird (Luo et al. 2020).
Abbildung 3: CRISPR-Cas9 Genom-Editierung zum gezielten Knockout des Ryanodin-Rezeptors (RYR2). (A) Schema zur Cas9-vermittelten Induzierung von Doppelstrangbrüchen, welche im Rahmen der endogenen DNA-Reparatur zu Mutationen, beispielsweise Insertionen oder Deletionen, führen können und zum verfrühten Abbruch der Transkription führen. (B, C) Unterbinden der Transkription der für die biologische Funktion des RYR2 essentiellen Membrandomäne (B) und der daraus resultierende Knockout des RYR2 auf Proteinebene, welcher beispielsweise mittels Immunfluoreszenzfärbungen (C) nachgewiesen wurde (Luo et al., 2020).
II. iPS-Zellbasierte Krankheitsmodellierung
Genomweite Assoziationsstudien haben gezeigt, dass viele menschliche Erkrankungen durch monogene Defekte in Genen verursacht werden können, die für strukturelle oder regulatorische Proteine codieren. Diese, aus genetischen defekten resultierenden Erkrankungen, sind im Bereich der Herz-Kreislauf-Forschung äußerst relevant, worauf dieser Themenbereich unserer Forschung abzielt. In unserer Arbeitsgruppe haben wir verschiedene iPS-Zelllinien von Patienten etabliert, die an genetisch bedingten Herzkrankheiten leiden (z.B. katecholaminerge polymorphe ventrikuläre Tachykardie, Brugada-Syndrom, Long-QT-Syndrom, Barth-Syndrom, Vici-Syndrom und dilatative Kardiomyopathie). Da die iPS-Zellen und die aus den iPS-Zellen gewonnenen Zellen das identische Genprofil wie die jeweiligen Patienten aufweisen, verwenden wir patientenspezifische iPS-Zellen, um diese Krankheitsbilder in der Zellkulturschale zu rekapitulieren und zu untersuchen. Derzeit versuchen wir durch den Einsatz dieser patientenspezifischen iPS-Zellen und aus diesen differenzierten Herzmuskelzellen, einen vertieften Einblick in die genetisch-bedingten pathophysiologischen Mechanismen zu bekommen, die an der Entstehung von Herzinsuffizienz und Herzrhythmusstörungen in diesen Patienten beteiligt sind. So konnten wir zeigen, dass Kardiomyozyten, die aus iPS-Zellen von einem Patienten mit Brugada-Syndrom (durch Mutation p.S1812X im Natriumkanal-Gen SCN5A), differenziert wurden, die elektrophysiologische Dysfunktion der Herzmuskelzellen in vitro rekapitulieren, beispielsweise anhand einer gestörten Depolarisierung und einer verlangsamten Erregungsweiterleitung. Um den Einfluss einer spezifischen Mutation auf die molekulare Funktion und Fehlfunktionen der Zellen zu charakterisieren, setzen wir zudem CRISPR/Cas9-basierten Geneditierung ein. So sind wir in der Lage, die mutierten Gene zu korrigieren mit dem Ziel dadurch den normalen Phänotyp wiederherzustellen. Die Korrektur des defekten Zielgens ist zudem wichtig um sicherzustellen, dass die Mutation in dem Patienten tatsächlich die Ursache der Krankheit ist und leistet somit einen wichtigen Beitrag zur molekularen Diagnosestellung leisten.
III. Validierung therapeutischer Targets
In den vergangen zwei Jahrzehnten wurden viele verschiedene Tiermodelle zur Untersuchung menschlicher Krankheiten etabliert, um die Entstehung, Entwicklung und das Fortschreiten von Krankheiten zu verstehen. Allerdings können Tiermodelle allein betrachtet, aufgrund der bestehenden genetischen und physiologischen Unterschiede zum Menschen, oft nur unzureichend die Mechanismen menschlicher Erkrankungen widerspiegeln. Dagegen sind Untersuchungen zur Validierung von therapeutischen Targets am Menschen nur begrenzt möglich und die Verfügbarkeit von menschlichem Gewebe/Zellmaterials ist oftmals sehr limitiert. Hier ermöglichen unsere iPS-zellbasierten Modellsysteme es, biochemische Analysen an gezüchtetem menschlichem Gewebe durchzuführen und die an der menschlichen Physiologie beteiligten Signalwege und Schlüsselmoleküle aufzuklären. In diesem Themenbereich bearbeiten wir verschiedene Projekte, die sich mit der Rolle spezifischer Targets im Rahmen von diabetischer Kardiomyopathie bzw. metabolischen Herzerkrankungen, Ischämie-Reperfusionsschädigung oder den Signalwegen zyklischer Nukleotide für bei Arrhythmien. So validieren wir neue therapeutische Zielstrukturen und gewinnen wichtige Einblicke in die Wirkungsweise von potentiellen neuen Wirkstoffen.
IV. Etablierung iPS-basierter in vitro Modellsysteme verschiedener Gewebetypen für Wirkstofftestung
Etwa 30% der neu entwickelten Wirkstoffe werden in der klinischen Prüfung aufgrund mangelnder Wirksamkeit wieder aufgegeben. Ein wesentlicher Grund dafür ist, dass die präklinischen Studien in der Arzneimittelentwicklung stark auf Tiermodellen basieren. Es wurde beispielsweise eine Reihe an Medikamenten entwickelt, die therapeutische Wirksamkeit im Tiermodell von amyotropher Lateralsklerose zeigten, jedoch bei der nachfolgenden Anwendung am Patienten unwirksam waren. Dies unterstreicht die Notwendigkeit der Entwicklung von Krankheitsmodellen auf Basis humaner Zellen für die präklinische Wirkstoffvalidierung. Auf humanen iPS-Zellen basierende Zellkulturmodelle sowie in vitro generierte Organ-ähnliche Gewebe (Organoide) sind vielversprechende Ansätze, um die Lücke zwischen der klassischen Tiermodell-basierten präklinischen Entwicklung und der klinischen Realität zu überbrücken. Derzeit konzentrieren wir uns auf die Etablierung einer gerichteten Differenzierung von iPS-Zellen zu somatischen Zellen, einschließlich Kardiomyozyten, Nervenzellen und Hepatozyten. Darüber hinaus werden eine Reihe von menschlichen Organoid-Kulturgeweben (u. a. kardiovaskuläre, zerebrale und hepatische Organoide), die aus strukturierten dreidimensionalen Zellverbänden bestehen, aus patientenspezifischen iPS-Zellen hergestellt. Wir werden den Einfluss von experimentellen Substanzen (z.B. Antiarrhythmika) - mit spezifischer wie auch pleiotroper Wirkung - auf die Eigenschaften von menschlichen Kardiomyozyten testen und insbesondere die Mechanismen untersuchen, wie diese Substanzen zu einer verbesserten Funktion führen. Aus diesem Grund sind unsere auf patientenspezifischen iPS-Zellen basierenden Modelle besonders wertvoll und ermöglichen es uns, alle relevanten pathophysiologischen Aspekte zu charakterisieren, auch wenn die Krankheit mehrere Organe betrifft.
Ein weiteres Kernproblem neben der mangelnden Wirksamkeit neue-entwickelter Wirkstoffe im menschlichen Organismus ist die Toxizität dieser neuen Substanzen. Obwohl während der präklinischen Arzneimittelentwicklung mindestens zwei in vivo-Tiermodelle (mindestens ein Nagetier- und ein Nicht-Nagetier) zur Abschätzung der Toxizität eines neuen Arzneimittels verwendet werden, wurden weitere 30% der Arzneimittel, die in klinischen Studien getestet wurden, aufgrund von Sicherheitsbedenken, wie Kardiotoxizität und Hepatotoxizität, aufgegeben.
Aus menschlichen iPS-Zellen abgeleitete Kardiomyozyten und Hepatozyten stellen ein einzigartiges und prädiktives Modell dar, um potenzielle kardiotoxische und hepatotoxische Wirkungen neuer pharmakologischer Wirkstoffkandidaten bereits in der Phase der präklinischen Testung zu untersuchen.
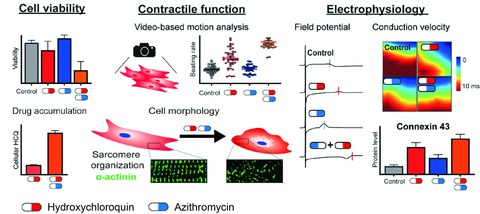
Abbildung 4: Charakterisierung von kardiotoxischen Effekten der Azithromycin-Hydroxychloroquin Kombinationstherapie mittels iPS-Kardiomyozyten unter Verwendung unseres breiten Methodenspektrums. Unsere Studien zeigten, dass die negativen Effekte beider Substanzen auf die Vitalität, Struktur und kontraktile- sowie elektrophysiologische Funktion humaner Herzmuskelzellen durch deren Kombination synergistisch verstärkt werden (Li et al., 2022).
Laufende Projekte
Leptin and leptin receptor signalling in diabetic cardiomyopathy
International Research Training Group 2251: Immunological and Cellular Strategies in Metabolic Disease (ICSMD); Link: https://tu-dresden.de/med/mf/irtg2251
Kontakt: Prof. Dr. Kaomei Guan
Mitarbeiter: Dr. Anna Strano, MSc. Irem Congur, MSc. Vanya Milanova, MSc. Fatima Kanwal Baig, MD Josie Schnarr
Leptin ist ein zentrales Hormon für die Regulation der Nahrungsaufnahme in dem es das Sättigungsgefühl auslöst und so den kalorischen Input limitiert. Mutationen im Leptin oder dem Leptinrezeptor führen zu schweren Formen der Adipositas, die sich bereits im Kindesalter ausprägen. Eine Resistenz gegenüber Leptin ist zudem verbreitet bei Patienten mit Adipositas oder stark übergewichtigen Typ-2 Diabetikern aus, in denen ebenso eine verminderte Insulinsensitivität oder Insulinresistenz relevant ist. Diese Patienten weisen ebenso eine hohe Prävalenz zur Entwicklung von Herzinsuffizienz bzw. kardiale Komplikationen aus, beispielsweise der diabetischen Kardiomyopathie. Dieses Projekt zielt darauf ab, die Rolle von Leptin bzw. einer gestörten Leptin-Signalkaskade (mittels CRISPR/Cas9), für die Entwicklung der diabetischen Kardiomyopathie mittels, aus induzierten pluripotenten Stammzellen-differenzierten, humanen Kardiomyozyten zu erforschen.
„MultiMOD“ - Smart Material-basierte Schaltkreise für den Multimodalen Informationsraum
ESF/ESF Plus Projekt Projekt (Sprecher: Prof. Dr. Andreas Richter)
Link: https://tu-dresden.de/ing/elektrotechnik/ihm/ms/forschung
Kontakt: Prof. Dr. Kaomei Guan
Mitarbeiter: Dr. Mario Schubert, Dr. Xiaojing Luo, Dr. Anna Strano
Die Nachwuchsforschungsgruppe MultiMOD beschäftigt sich mit den Grundlagen eines Schaltkreis- und Informationsverarbeitungskonzeptes auf Basis smarter Materialien. Dies ermöglicht die direkte Verarbeitung verschiedener physikalischer, chemischer und biologischer Informationsträger in unserer Umwelt, ohne dass elektronische Komponenten benötigt werden. Diese Schaltkreise ermöglichen die Integration von viel mehr Funktionen auf Chipebene, einschließlich Informationsverarbeitung, Energieversorgung, Sensorik und Aktorik. Sie sind äußerst energieeffizient und benötigen nur einen Bruchteil der Ressourcen, die in herkömmlichen mikroelektronischen Systemen verwendet werden, und sind in hohem Maße recycelbar. Die Nachwuchsforschungsgruppe konzentriert sich auf drei spezifische Anwendungen in den Biowissenschaften, die in hohem Maße von den Fähigkeiten dieser multimodalen Schaltkreise profitieren können: Multi-Organ-on-Chip-Systeme mit komplexen chemisch-biologischen Regulationsmechanismen, multimodale Schaltkreise für die Krebsfrüherkennung und mikrorobotische Systeme mit naturgetreuen Fähigkeiten für den Einsatz als Operationsroboter (EHMs aus iPS-Kardiomyozyten).
Stammzell-basiertes in-vitro Werkzeug zur differenzierten Präzisionsdiagnostik und Therapieentwicklung für Herzerkrankungen (CardioEpiX)
Gefördert durch Sächsische Aufbaubank (SAB)
Kontakt: Prof. Dr. Kaomei Guan
Mitarbeiter: Dr. Wener Li, Dr. Mario Schubert
Vorhofflimmern (VHF) ist eine der Hauptursachen für Schlaganfälle, Herzinfarkt und Herzversagen, die weltweit mit einer erheblichen Morbidität und Mortalität einhergehen. Um dem globalen Ausmaß von VHF zu begegnen ist es notwendig, neue Werkzeuge zu entwickeln, die die Ansprüche hinsichtlich differenzierter Früherkennung, präziser Klassifikation und Therapieentwicklung bedienen.
Das CardioEpiX Projekt setzt genau hier an und bietet eine Lösung zur präzisen Patienten- und Krankheitsbild-differenzierten in-vitro Diagnostik von verschiedenen Formen von VHF. Das Konsortium besteht aus einem sächsischen KMU (Sciospec Scientific Instruments GmbH) und zwei sächsischem Forschungseinrichtungen (TU Dresden und Universität Leipzig).
An der TU Dresden konzentrieren wir uns auf die Darstellung klinisch relevanter, verschiedener Formen von VHF mittels in-vitro Phänotypisierung von patientenspezifischen induzierten pluripotenten Stammzell-abgeleiteten Kardiomyozyten sowie auf die Effektivitäts- und Risikostratifizierung von Arzneimitteln mit Hilfe der VHF-Modelle.
Die Europäische Union bietet vielfältige Förderprogramme an, um Forschung und Bildung als wertvolles öffentliches Gut zu unterstützen. Unser Projekt wurde aus Mitteln des Europäischen Fonds für Regionale Entwicklung (EFRE) gefördert.
Technologieplattform für modulare Mikro-Physiologische Systeme (TECH-MPS)
Gefördert durch Sächsische Aufbaubank (SAB), Projektlaufzeit: 15.08.2025-31.12.2027
Kontakt: Prof. Dr. Kaomei Guan
Mitarbeiter: Dr. Mario Schubert, Dr. Anna Strano, MSc. Pranotee Gawade, MSc. Oliver Gamm, MSc. Yuliya Dzekhtsiarova, BSc. Grenti Rrukaj, Konstanze Fischer
Die Abhängigkeit von Tierversuchen in der Erforschung und Zulassung von Arzneimitteln stellt eine erhebliche ethische und praktische Herausforderung dar. Kernproblem ist eine eingeschränkte Übertragbarkeit der Ergebnisse von Tierversuchen auf den Menschen. Hier bietet der Einsatz humaner Zellmodelle in Kombination mit mikrophysiologischen Systemen (MPS) eine nachhaltige Alternative zur Optimierung der Wirkstoffforschung in Bezug auf Effizienzsteigerung, Kostenreduktion, und zur Reduktion von Tierversuchen.
Das Ziel des Projekts TECH-MPS besteht in der Entwicklung einer ganzheitlichen Lösung, welche neben einer flexibel und modular einsetzbaren MPS-Plattform eine nahtlose Integration und Analyse der Daten aus den Bereichen Fertigung, Vorkultivierung der Zellen und Geweben, Kultivierung im MPS sowie experimentell generierten Daten ermöglicht.
In unserer Gruppe fokussieren wir uns auf die Herstellung humaner Zellmodelle und der Etablierung eines Myokardinfarkt-Modells als Referenzanwendung für das MPS. Mithilfe dieses Modells sollen Mechanismen zur Reduzierung der Herzmuskelschädigung erforscht und Arzneimittelkandidaten getestet werden.
Konsortium/Projektpartner:
Interaktion von Kardiomyozyten und kardialer Fibroblasten in Entwicklung und Pathophysiologie
Ehemals gefördert durch MeDDrive Grant der TU Dresden (zu Dr. M. Schubert)
Link zum Projekt
Kontakt: Dr. Mario Schubert, Prof. Dr. Kaomei Guan
Mitarbeiter: MD Paul Josef Conrad Beck
Maturierung von iPS-Kardiomyozyten in 2D und 3D Modellen für Wirkstofftestung und Krankheitsmodellierung
Ehemals gefördert durch MeDDrive Start der TU Dresden (zu Dr. M. Schubert)
Link zum Projekt
Kontakt: Dr. Mario Schubert, Prof. Dr. Kaomei Guan
Mitarbeiter: MD Paul Josef Conrad Beck, MSc. Oliver Gamm, MSc. Yuliya Dzekktsiarova, MD Paul Geppert