Forschung
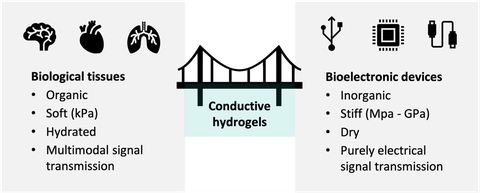
Bioelektronische Geräte helfen Patienten auf der ganzen Welt, an einem normalen Leben teilzuhaben, indem sie verlorene Körperfunktionen ersetzen. Die in diesen Geräten verwendete Elektronik auf Metallbasis weist heutzutage eine große physiko-chemische Diskrepanz zur lebenden Materie auf. Die Materialien sind anorganisch, starr und trocken. Das biologische Gewebe, an das sie angrenzen, ist organisch, weich und hydratisiert. Diese Diskrepanz führt zu massiven Einschränkungen bei der langfristigen Nutzung moderner bioelektronischer Geräte.
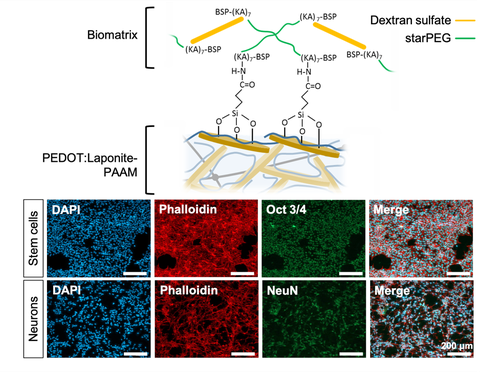
Mit leitfähigen Hydrogelen können wir die physikalisch-chemischen Eigenschaften von lebendem Gewebe in Kombination mit hoher elektrischer Leitfähigkeit in einem einzigen Materialsystem nachbilden. Hydrogele sind hydratisierte Polymere, deren mechanische Eigenschaften so eingestellt werden können, dass sie so weich sind wie das Gewebe, an das sie sich anschmiegen. Durch die Kombination geladener kolloidaler Partikel (Laponit), eines kovalenten Polymer-Hydrogels (Polyacrylamid) und des leitfähigen Polymers Poly(3,4-ethylendioxythiophen) (PEDOT) können wir hochleitfähige, organische und weiche, sich gegenseitig durchdringende Polymernetzwerke herstellen.
Die negativen Ladungen der in die Polyacrylamidmatrix eingebetteten Laponitpartikel wirken als Dotierstoff für das leitfähige Polymer. Dies führt zu einer massiv erhöhten Leitfähigkeit im Vergleich zu undotierten Hydrogelen. Darüber hinaus stärkt die elektrostatische Wechselwirkung der Partikel das Polymernetzwerk und macht es hochelastisch. Dies macht die Materialien über mehrere Dehnungszyklen hinweg stabil, wobei die Leitfähigkeit während der Dehnung nur minimal abnimmt.
Ein weiterer Vorteil von Polymeren gegenüber Metallen ist die Möglichkeit, sie mit verschiedenen Molekülen chemisch zu funktionalisieren. Mit Hilfe einer chemisch definierten, künstlichen Biomatrix können die Materialien von bioinert zu stark zelladhäsiv umgewandelt werden. Dies bietet die Möglichkeit, die Materialien in Abhängigkeit von der spezifischen Anwendung und dem Gewebetyp, an den sie angrenzen sollen, zu optimieren. In dem gezeigten Beispiel wurden die Materialien für Stammzellen und Neuronen klebrig gemacht.
Perspektivisch planen wir die Entwicklung von Materialien, die nicht nur die physikalisch-chemische Diskrepanz, sondern auch die funktionelle Diskrepanz zwischen der rein elektrischen Signalübertragung in Metallen und der vernetzten Signalübertragung (biomolekular und elektronisch) in lebenden Geweben überwinden. Wir erwarten, dass wir mit diesem Ansatz bioelektronische und biomedizinische Geräte revolutionieren und die Kluft zwischen lebender Materie und Elektronik weiter überbrücken können.
Methoden und Fachwissen
- Herstellung von leitfähigen Polymer-Hydrogel-Verbundwerkstoffen
- Elektrische Charakterisierung von Hydrogelen (elektrische Impedanzspektroskopie, zyklische Voltammetrie, Chronoamperometrie)
- Mikrofabrikation (Lithographie, Softlithographie, Mikrofluidik, 3D-Druck)
- Studien zur Bindung und Freisetzung von Molekülen
- Organische elektrochemische Transistoren