Jan 31, 2025
Easing the Pressure: Tight Junctions Reduce Cell Tension to Facilitate Inflow of Water during Organ Development
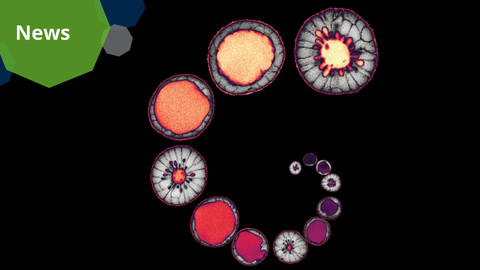
Montage of a MDCK cyst model used by the Honigmann group in this study.
Many organs, such as the kidneys and intestines, consist of fluid-filled cavities that are crucial for their function. The body builds such organs by a coordinated effort of many cells, which move water to create a fluid-filled space inside the tissue. A recent study by the Honigmann group at the Biotechnology Center (BIOTEC) of TUD Dresden University of Technology reveals how cells regulate this process. The team discovered that tight junctions play an unexpected role in controlling water flow during organ formation. Their findings, published in Developmental Cell, offer new insights into the mechanics of organ development.
Tight junctions are protein-based cell connections that seal the gap between neighboring cells. Until now, researchers believed that tight junctions mainly control the passage of small molecules across the organ boundaries. However, a team led by Prof. Alf Honigmann showed that tight junctions actively facilitate the entry of water into developing organs by reducing mechanical tension between the cells.
“Formation of fluid-filled cavities is an essential step in organ development,” says Prof. Alf Honigmann, a research group leader at BIOTEC and the project leader. “Epithelial cells lining the organs rely on passive osmosis to transport water inside the organ. How the cells control the physical forces that determine the direction of water flow during osmosis was unclear.”
Tight Versus Relaxed
The key lies in how tight junctions regulate the cytoskeleton inside the cells. When water enters the tissue cavity, it effectively inflates the tissue similar to how a rubber balloon is inflated with air. The amount of force required to inflate the tissue depends on how strongly the cytoskeleton resists it. If the cytoskeletal force is too high, water cannot enter or will even be pushed out. The Honigmann team found that during organ development, tight junctions relax the cytoskeleton, which reduces the tension between the cells and makes it easier for water to inflate the tissue.
“Our research shows that tight junctions not only create a tissue barrier but also control the mechanical force balance, making water influx easier,” says Prof. Honigmann, “By reducing the tension between neighboring cells, they soften organ boundaries and allow water to inflate the tissue cavity more efficiently.”
Looking Into the Future
This discovery expands our understanding of how organs develop and provides new avenues to study diseases where water flow is disrupted, such as cystic fibrosis.
“With this finding, we open up a new set of questions about the role of tight junctions in developmental biology. Understanding the role tight junctions play in water management could provide new insights into the molecular mechanism of various diseases caused by improper organ development,” concludes Prof. Honigmann.
Original Publication
Markus Mukenhirn, Chen-Ho Wang, Tristan Guyomar, Matthew J. Bovyn, Michael F. Staddon, Rozemarijn E. van der Veen, Riccardo Maraspini, Linjie Lu, Cecilie Martin-Lemaitre, Masaki Sano, Martin Lehmann, Tetsuya Hiraiwa, Daniel Riveline, Alf Honigmann: Tight junctions control lumen morphology via hydrostatic pressure and junctional tension. Developmental Cell (November 2024)
Link: https://doi.org/10.1016/j.devcel.2024.07.016
