Albert Gruppe
Der Neokortex gilt als Zentrum für höhere kognitive Funktionen beim Menschen. Der Neocortex findet sich nur in Säugetieren und seine Expansion und Faltung sind Kennzeichen der menschlichen Evolution. Die Nervenzellen des Neocortex werden während der Entwicklung aus neuralen Stamm- und Vorläuferzellen erzeugt. Epigenetische Mechanismen spielen eine zentrale Rolle bei der Steuerung des Verhaltens von Stammzellen während der Entwicklung. Uns interessieren im Besonderen, die Mechanismen, die die Aktivität von Genen in neuralen Stammzellen regulieren. Ein Verständnis davon, kann möglicherweise Fragen der Neokortexentwicklung und -evolution, der neuralen Stammzellregulation und der Entstehung von Entwicklungsstörungen des Gehirns beantworten.
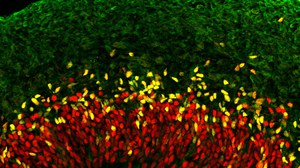
Abbildung: Neurale Vorläuferzellen des Neokortexes während der Entwicklung. Während der Neurogenese bilden neurale Vorläuferzellen (SOX2/rot; TBR2/gelb) Nervenzellen (TUJ1/grün) aus. Bild von Theresa Schütze.
 © Theresa Schütze
© Theresa Schütze
Future projects and goals
Die Ziele unserer Forschung sind
- Weiterentwicklung von in vivo-Epigenom-Editierwerkzeugen, um die Rolle von Histonmodifikationen an spezifischen Loci während der Entwicklung zu untersuchen
- zu verstehen, wie epigenetische Mechanismen zur präzisen Regulation der Entwicklung des Neokortex beitragen
- Identifizierung und Charakterisierung genregulatorischer Regionen, die möglicherweise zur Evolution des menschlichen Gehirns beigetragen haben
- die Rolle nicht-kodierender genetischer Varianten bei Krankheiten der Nervenentwicklung zu untersuchen
Epigenetische Regulation der Entwicklung des Neokortex
Während der Entwicklung des Neokortex der Maus vermehren sich Stamm- und Vorläuferzellen zunächst, dann entstehen nacheinander Neuronen, die für verschiedene Kortikalisschichten bestimmt sind, und schließlich wechseln sie zur Gliogenese, was zur Bildung von Astrozyten und Oligodendrozyten führt. Eine präzise räumliche und zeitliche Regulation der neuralen Vorläuferzellen-Differenzierung ist der Schlüssel für die korrekte Ausbildung der komplexen Struktur des Neokortex. Eine Beeinträchtigung der Entwicklung des Gehirns, wie sie bei Patienten mit neurologischen Entwicklungsstörungen beobachtet wird, ist häufig mit einer Beeinträchtigung der intellektuellen Fähigkeiten verbunden.
Es ist bekannt, dass Chromatinmodifikatoren aus der Gruppe der Polycomb-Proteine mehrere verschiedene Aspekte der Neokortexentwicklung regulieren (Albert und Huttner, 2018). Durch Epigenom-Profiling in spezifischen neuralen Zellpopulationen haben wir gezeigt, dass die Polycomb- und Trithorax-vermittelte Histon-Methylierung während der Entwicklung des Neokortex hochdynamisch ist (Albert et al., 2017). Darüber hinaus konnten wir durch CRISPR/Cas9-basierte Epigenom-Editierung in vivo zeigen, dass die Veränderung der Histon-Methylierung an einem spezifischen Promotor ausreicht, um die Expression eines wichtigen neuronalen Transkriptionsfaktors zu reduzieren, was zu einer veränderten Abundanz neuraler Vorläuferzellen führt (Albert et al., 2017). Wir arbeiten weiter an der Entwicklung von Instrumenten zur in vivo-Epigenom-Editierung, die genspezifische funktionelle Studien der Epigenetik im sich entwickelnden Gehirn ermöglichen.
Evolutionäre Erweiterung des Neokortex
Es wird angenommen, dass Unterschiede zwischen den Arten sowohl in der Neuronenzahl als auch in der Größe des Neokortex aus Unterschieden in der Proliferationskapazität und der Häufigkeit von neuralen Vorläufer-Subtypen resultieren. Insbesondere ein Vorläufertyp, die basale radiale Glia, ist besonders häufig bei Säugetieren mit einem großen, gefalteten Neokortex anzutreffen und zeichnet sich durch umfangreiche Selbsterneuerungs- und Proliferationskapazitäten aus. Transkriptomstudien an verschiedenen Säugetierspezies haben Gene aufgedeckt, die in der menschlichen basalen radialen Glia exprimiert werden, darunter human-spezifische Gene, die möglicherweise zur Neokortexexpansion während der Evolution beigetragen haben (Florio et al., 2015; Florio et al., 2018; Kalebic et al, 2018). Die genregulatorischen Mechanismen, die spezifische Genexpressionsprogramme aus der genomischen DNA in verschiedenen neuralen Vorläuferzelltypen in verschiedenen Spezies orchestrieren, sind jedoch nach wie vor nur unzureichend verstanden.
Die Gentranskription wird an Promotorsequenzen unmittelbar stromaufwärts eines Gens initiiert, aber die differentielle Genexpression in spezifischen Zelltypen wird durch oft distal gelegene regulatorische Elemente gesteuert. Diese komplexe regulatorische Landschaft ermöglicht es den Zellen, auf Entwicklungs- und Umweltreize zu reagieren. Interessanterweise haben genomweite Assoziationsstudien aufgedeckt, dass mehr als 90% der krankheitsassoziierten Varianten in nicht-kodierender DNA liegen, was darauf hindeutet, dass eine Dysregulation der Genexpression zur Krankheit beiträgt (Krijger und de Laat, 2016). Wir untersuchen die Genregulation mit Hilfe von in-vivo-Modellen sowie neuartigen in-vitro-3D-Hirnorganoiden, die durch humane pluripotente Stammzellen induziert wurden. Unsere Arbeit zielt darauf ab, neue Einsichten in genregulatorische Mechanismen mit Auswirkungen auf die Evolution des Neokortex sowie auf Neuropathologien zu gewinnen.
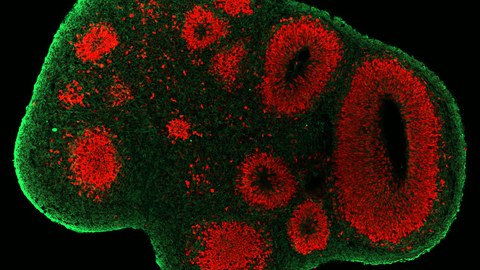
Abbildung: Zerebrale Organoide als neue Modelle zur Untersuchung der menschlichen Neurogenese. Die Generierung menschlicher Hirnorganoide aus induzierten pluripotenten Stammzellen ermöglicht die Untersuchung von menschlichen neuralen Vorläuferzellen (SOX2/rot) und Neuronen (TUJ1/grün). Bild von Theresa Schütze.