Forschung
FRÜHERE UND AKTUELLE FORSCHUNG
Ein Forschungshighlight, das den Grundstein für unser Labor legte, war der erste Nachweis für die experimentelle Stimulation einer regenerativen Reaktion in der Netzhaut von Säugetieren: Der Haupttyp der Gliazellen in der Netzhaut, Müllerglia, kann in vivo neue Nervenzellen (Regeneration) in der geschädigten adulten Netzhaut der Maus produzieren (Karl et al PNAS 2008). Ob eine regenerative Reaktion in der menschlichen Netzhaut hervorgerufen werden kann, ist jedoch noch unbekannt.
Es ist bekannt, dass Glia zumindest andere Funktionen mit günstigen, aber auch schädlichen Folgen erlangen können, die entweder vorbeugend und schützend wirken oder aber Netzhauterkrankungen verursachen bzw. zu ihnen beitragen. Auch die Regulationsmechanismen, die die Regeneration erleichtern und einschränken, und diejenigen, die andere Glia-Funktionen bei Pathologien steuern, sind noch unvollständig verstanden.
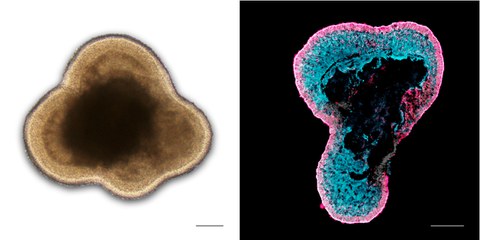
Left: Brightfield microscopy image of a living human retinal organoid in cell culture; Right: Immunostained image of a human retinal organoid section labeled for photoreceptors (RCVRN, magenta) and Müller glia (RLBP1, cyan)
Eine grundlegende Frage, der wir in unserer Forschung nachgehen, ist daher, ob die Bildung neuraler Narben und die pathologische Funktion von Glia- und Neuronen - die für AMD und andere Netzhautpathologien beim Menschen von hoher Relevanz sind - Teil einer fehlregulierten Regenerationsreaktion oder getrennte Einheiten sein könnten.
Darüber hinaus entwickeln und optimieren wir zur Modellierung der neuronalen Degeneration und Regeneration in der menschlichen Netzhaut Methoden zur Erzeugung menschlicher Netzhäute im Labor: Pluripotente Stammzellen können in Zellkultur differenziert werden, um 3D-organähnliche Strukturen - so genannte retinale Organoide - zu entwickeln. Gegenwärtig wenden wir Organoide der Maus und der menschlichen Netzhaut an, um pathologische Prozesse der Netzhaut effektiv zu reproduzieren, wobei wir uns besonders auf Zapfen- und Stäbchen-Photorezeptor-Dystrophien und Glia-Pathologien konzentrieren.
ZUKÜNFTIGE PROJEKTE UND ZIELE
Unser derzeitiges Gesamtziel ist es, aus menschlichen Stammzellen gewonnene neuronale Organoid- und Zellsysteme speziell für die Netzhaut zu entwickeln, diese anzuwenden, um Mechanismen der neuronalen Degeneration und Regeneration zu verstehen und dadurch neue therapeutische Strategien für ein breites Spektrum an Patient:innen zu finden, insbesondere für die altersbedingte Makuladegeneration (AMD).
Interessieren Sie sich für detaillierte Ziele? Bleiben Sie dran!
