Partikelstabilisierte adsorptive Blasenseparation getaggter Enzyme
Kontaktperson: Dr.-Ing. Sascha Heitkam (Projektverantwortlicher), Dr.-Ing. Karin Schwarzenberger
Projektbearbeiter: Dr. Behnam Keshavarzi
Finanzierung: Deutsche Forschungsgemeinschaft (DFG), Förderkennzeichen HE 7529/2-1
Kooperation: Professur für Molekulare Biotechnologie, TU Dresden
Motivation:
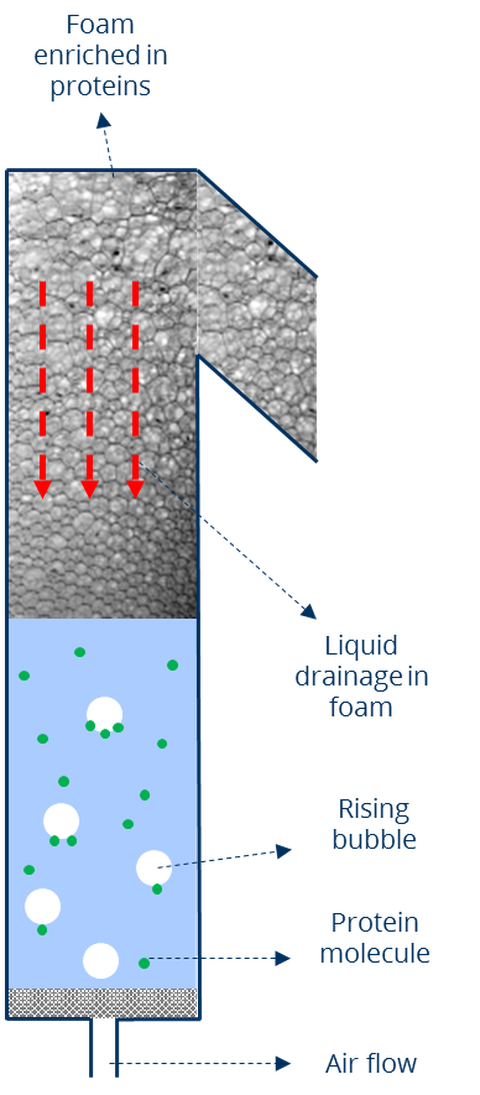
Schaumflotation von Proteinen
Enzyme sind Proteine mit einer bestimmten Funktionalität und spielen eine wichtige Rolle in der Biotechnologie mit Anwendungen in den Bereichen Lebensmittel, Medizin, chemische Produktion usw. Die erschwingliche Bereitstellung von Enzymen war jedoch schon immer ein großer Engpass. Ein Hauptproblem dabei ist der Mangel an kostengünstigen Methoden zur Abtrennung von Enzymen aus dem Rohmedium, die auch die enzymatische Aktivität erhalten. In dieser Hinsicht scheint die adsorptive Blasenseparation (ABS) ein vielversprechender Ansatz zu sein. Bei der ABS adsorbieren die Zielmoleküle an der Grenzfläche von aufsteigenden Luftblasen, die in die wässrige Lösung eingebracht werden, und werden von diesen an die Flüssigkeitsoberfläche transportiert, wobei sich an der Oberfläche ein Schaum bildet. Die im Schaum mitgerissene Flüssigkeit fließt nach unten ab (Schaumdrainage), während der Schaum über ein Wehr fließt und aufgefangen wird. Die Zielstoffe werden durch Schaumabscheidung und Verflüssigung zurückgewonnen.
Zwei wesentliche Faktoren bei der Enzymabtrennung durch ABS sind jedoch, dass 1) die direkte Adsorption des Zielenzyms an der Gas-Flüssigkeits-Grenzfläche zur Denaturierung und damit zum Verlust der katalytischen Aktivität führt und 2) Tenside nicht verwendet werden dürfen, um die Schaumstabilität bei den Enzymen zu gewährleisten, da die Tenside als starke Inhibitoren der Enzymfunktion wirken und die anschließende Abtrennung der Tenside von den Enzymen noch schwieriger ist.
Daher wird in dieser Arbeit ein Tag an die Enzymmoleküle angebracht, so dass der Tag in direkten Kontakt mit der Blasengrenzfläche kommt und das Enzym von der Grenzfläche fernhält. Darüber hinaus erhöht der Tag die für eine ordnungsgemäße Trennung erforderliche Schaumstabilität.
Ziele:
- Anbringung eines molekularen Tags an das Zielenzym, der die Adsorptionsrate an der Grenzfläche erhöht und gleichzeitig den direkten Kontakt zwischen dem aktiven Teil des Enzyms und der Grenzfläche verringern kann.
- Untersuchung der Adsorption von Proteinen/Enzymen an aufsteigenden Blasen.
- Optimierung des Flotationsverfahrens, um die Proteinadsorption an der aufsteigenden Blase zu verbessern und eine optimale Schaumstabilität zu erreichen, um die höchste Ausbeute und Qualität zu erzielen. Bei Bedarf können auch Partikel hinzugefügt werden, um die Schaumstabilität zu erhöhen.
- Modellierung des Proteinflotationsprozesses zur Durchführung einer Parameterstudie über verschiedene Betriebsparameter sowie für Upscaling-Zwecke.
Methoden:
- Dynamische Oberflächenspannungsmessung (PAT, Sinterface): zur Messung der Dynamik der Proteinadsorption an der Luftgrenzfläche und zur Untersuchung der irreversiblen Adsorption von Proteinen.
- Flow-on-Bubble-Tests: zur Bewertung der Proteinadsorption an aufsteigenden Blasen.
- Dynamische Schaumanalyse (DFA-100, Krüss): zur Untersuchung des Verhaltens von Proteinschäumen, z. B. durch Messung der Vergröberungsrate und des Flüssigkeitsanteils des Schaums mit der Zeit.
- Flotationsexperimente: zur Bewertung der Abtrennungseffizienz von Proteinen bei der ABS-Separation.
Ergebnisse:
- Die Flotation kann die Konzentration der Enzyme erhöhen, die Aktivitätsmessungen zeigten jedoch einen erheblichen Verlust an enzymatischer Aktivität, wenn die Enzyme mit den Blasen in Kontakt kommen.
- Es wurde festgestellt, dass viele Proteine (z. B. Bovines Serumalbumin) irreversibel an der Blasengrenzfläche adsorbieren.
- Die aufsteigende Blase wurde durch Flow-on-Bubble-Experimente nachgebildet.
- Die Koaleszenz des Schaums beschleunigt den Flüssigkeitsabfluss, was zu einer höheren Proteinanreicherung führt.
- Es wurde eine Modellierung vorgeschlagen, um die Ausbeute und den Gehalt bei der Proteinflotation abzuschätzen.
Publikationen:
- Behnam Keshavarzi, Thomas Krause, Sidra Sikandar, Karin Schwarzenberger, Kerstin Eckert, Marion Ansorge-Schumacher and Sascha Heitkam: Protein Enrichment by Adsorptive Bubble Separation: Experimental and Modeling. Chemical Engineering Science 256 (2022) 117715
- Behnam Keshavarzi, Thomas Krause, Karin Schwarzenberger, Marion Ansorge-Schumacher, Kerstin Eckert, Sascha Heitkam, Application of Flotation for Enzyme Purification, EUFOAM 2020 CONFERENCE, 6th-9th July, virtual meeting.
- Behnam Keshavarzi, Thomas Krause, Karin Schwarzenberger, Marion Ansorge-Schumacher, Kerstin Eckert, Sascha Heitkam, Evaluation of Protein Adsorption on Rising Bubbles, Annual meeting of the Processnet technical groups MPH and CFD, 9th-10th March 2021, virtual meeting.
- Behnam Keshavarzi, Thomas Krause, Karin Schwarzenberger, Marion Ansorge-Schumacher, Kerstin Eckert, Sascha Heitkam, Protein Enrichment by Flotation: Optimum Foam stability, ECIS 2021, 5th-10th September 2021, Athens, Greece.
- Behnam Keshavarzi, Thomas Krause, Karin Schwarzenberger, Marion Ansorge-Schumacher, Kerstin Eckert, Sascha Heitkam, Removal of Impurities From Protein Foam In Foam Fractionation Process by Wash Water Addition, 3rd-6th July 2022, Krakow, Poland.
