Structure and function: Rheology of enzymatically cross-linked milk
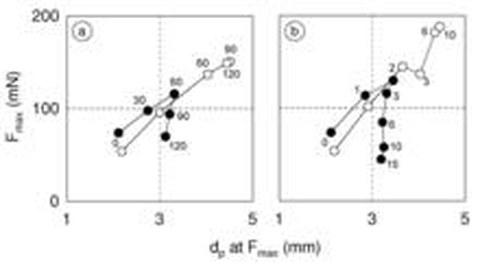
Large deformation properties of milk gels as a function of (a) incubation time (mTGase concentration: 3 U/g milk protein) and (b) mTGase concentration (incubation time: 60 min). in: Jaros D, Pätzold J, Schwarzenbolz U, Rohm H (2006) Small and large deformation rheology of acid gels from transglutaminase treated milks. Food Biophysics 1, 124-132
Microbial transglutaminase catalyzes the formation of isopeptides within and between protein molecules, leading to a modification of physical properties of protein-rich foods. Milk proteins, in particular the caseins and - after an appropriate pre-treatment - the whey proteins as well represent a good substrate for the enzyme, thus offering the potential use of microbial transglutaminase in the dairy industry to create newly structured products. Research studies on acid-induced milk gels revealed distinct differences in their rheological properties, depending on enzymatic treatment and applied deformation. Further studies on isolated protein fractions as model substrates and the application of different acidification agents should help to gain better knowledge on the impact of the enzyme on the structure-function relationship.
In cooperation with:
- Chair of Food Chemistry, Technische Universität Dresden
Project researchers and contact:
- Mandy Jacob
 © Sven Ellger
© Sven Ellger
Research Assistant
NamePD Dr.nat.techn. et Ing.habil Doris Jaros
Biomacromolecules
Send encrypted email via the SecureMail portal (for TUD external users only).