19.12.2023
Ein vorübergehendes Tauziehen: Ein Minimal-System entschlüsselt die Geheimnisse des Zelltransports
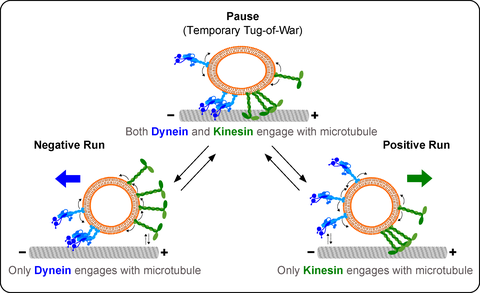
Die Abbildung zeigt, wie die Anzahl der an die Fracht gebundenen Kinesin- und Dynein-Motorproteine die Transportrichtung bestimmt. Wenn sowohl an Kinesinen als auch an Dyneinen gebunden, wird der Transport oft unterbrochen. Gelegentlich wird die Fracht von Motorproteinen in entgegengesetzte Richtungen gezogen, bevor schließlich einer siegreich ist.
Zellen sind geschäftige Konglomerate: Verschiedene Moleküle und Organellen müssen zu bestimmten Zeiten an verschiedene Orte geliefert werden. Wie genau sie ihre Ziele erreichen, ist eine seit langem ungelöste Frage der Biologie. Forschende der Diez-Gruppe am B CUBE - Center for Molecular Bioengineering der TU Dresden und der Santen-Gruppe am Zentrum für Biophysik der Universität des Saarlandes haben nun eine minimalisierte Version eines Zelltransportsystems außerhalb einer Zelle aufgebaut. Mit dessen Hilfe konnte das Team die Prinzipien der Steuerung der Transportrichtung ermitteln. Die neue Studie wurde im Fachjournal Nature Communications veröffentlicht.
Zellen sind wie geschäftige Fabriken. Sie müssen Moleküle und Organellen (Fracht) zuverlässig an verschiedene Zielorte innerhalb der Zelle transportieren. Defekte im zellulären Transport wurden mit vielen Krankheiten in Verbindung gebracht, darunter Alzheimer, Parkinson und Huntington. Der Transport beruht auf einem System von zellulären Schienen, den sogenannten Mikrotubuli. Zwei Arten von Motorproteinen, Kinesin und Dynein, können in entgegengesetzte Richtungen entlang der Mikrotubuli wandern, um die Fracht zu ihrem Ziel zu befördern. Zu jedem Zeitpunkt ist die Fracht an mehrere Kopien von Kinesin und Dynein gebunden. Sie bewegt sich jedoch nur in eine Richtung. Es ist unklar, was die Bewegungsrichtung bestimmt.
„Der intrazelluläre Transport ist ein kompliziertes System mit vielen Komponenten. Die Mikrotubuli selbst sind ein komplexes Gitter aus Proteinen, die bereits Einfluss auf den Transport der Fracht haben können. Darüber hinaus gibt es viele Proteine, die an Mikrotubuli oder an der Fracht gebunden sind, die den Transport regulieren könnten. Schließlich gibt es die schwankende Anzahl von Kinesin- und Dynein-Motoren zu jedem Zeitpunkt“, erklärt Prof. Stefan Diez, Forschungsgruppenleiter am B CUBE. „Aufgrund der Komplexität des Transports innerhalb der Zelle haben wir uns entschlossen, dieses System aus der Zelle zu nehmen, eine minimalisierte Version davon zu bauen und verschiedene Variablen separat zu testen.“
Ein Bottom-up-Ansatz
Das Team um Prof. Diez hat erfolgreich ein intrazelluläres Transportsystem außerhalb der Zelle mit gereinigten Komponenten aufgebaut. Ein solches minimales System, bestehend aus Mikrotubuli, Kinesin- und Dynein-Motoren und einer Phospholipid-Fracht, war ausreichend, um wichtige Merkmale des Transports in der Zelle zu reproduzieren.
„Andere Gruppen haben versucht, den intrazellulären Transport in-vitro zu rekonstituieren. Bisher blieben die meisten dieser Systeme allerdings entweder stationär oder haben die Fracht mit Geschwindigkeiten bewegt, die viel langsamer waren als die in den Zellen beobachteten. Unser System ist anders. Es funktioniert sehr ähnlich wie der natürliche Transport in der Zelle mit schnellen Läufen der Fracht in beide Richtungen, sporadisch auftretenden Pausen zwischen den Bewegungen und Richtungsänderungen – Merkmale, die für den Transport innerhalb der Zelle charakteristisch sind“, sagt Dr. Rahul Grover, ein Wissenschaftler in der Diez-Gruppe und einer der Autoren der Studie.
Ein Gleichgewicht zwischen den Motoren
Das Team verwendetete ein minimales System, um zu untersuchen, was die Richtung des Frachttransports bestimmt. „Wenn die Fracht nur an Kinesin oder Dynein gebunden wäre, würden wir erwarten, dass sie sich nur in eine Richtung bewegt. In Wirklichkeit ist sie jedoch immer an mehrere Kopien von Kinesin und Dynein gebunden. Dennoch bewegt sie sich nur in eine Richtung mit häufigen kurzen Unterbrechungen und ändert manchmal ihre Richtung“, sagt Dr. Ashwin D’Souza, ein ehemaliger Doktorand in der Diez-Gruppe und einer der Autoren der Studie.
Die Gruppe stellte fest, dass die Anzahl und Art der Motorproteine die Transportrichtung beeinflussten. Die Nettoanzahl von Kinesinen gegenüber Dyneinen, die an die Fracht gebunden waren und mit den Mikrotubuli interagierten, würde entscheiden, ob sie sich in eine Richtung oder in die andere bewegte. „Was uns jedoch verblüffte, war die Tatsache, dass die Anzahl der entgegengesetzten Motorproteine die Transportgeschwindigkeit nicht beeinflusste“, sagt Prof. Diez. Wenn sich die Fracht bewegte, dann immer mit einer Geschwindigkeit, als wären die entgegengesetzten Motoren nicht anwesend.
Ein vorübergehendes Tauziehen
Die Anwesenheit entgegengesetzter Motoren hatte jedoch einige andere deutliche Auswirkungen auf den Transport. Wenn die Fracht sowohl an Kinesin als auch an Dynein gebunden waren, wurde der Transport oft unterbrochen, um entweder die Richtung augenblicklich zu ändern oder die Bewegung überhaupt zu unterbrechen.
„Wir haben uns genauer angeschaut, was während solcher Pausen passiert. Gelegentlich würde sich die Fracht in ihrer Form verändern, bevor sie ihre Bewegungsrichtung umkehrt. Es sah so aus, als ob beide Motoren in entgegengesetzte Richtungen daran zogen, bevor schließlich einer gewann. Ein echtes Tauziehen im molekularen Maßstab“, erklärt Dr. Grover.
Das Team von Prof. Diez schloss sich mit der Gruppe von Prof. Santen am Center for Biophysics der Universität des Saarlandes zusammen, die Experten für theoretische Modellierung und Simulationen sind. Mit den Ergebnissen des minimalen Systems konnte die Santen-Gruppe numerische Simulationen durchführen, die zusätzliche Einsichten in den Entscheidungsprozess zur Transportrichtung lieferten.
Mithilfe von Computersimulationen konnte die Santen-Gruppe verschiedene Motorkonfigurationen identifizieren, die zu Richtungsänderungen führen können. Sie fanden heraus, dass die Pausen und Richtungsänderungen nicht von zusätzlichen Faktoren reguliert werden müssen. Diese Veränderungen können durch eine geringe Anzahl an Motorproteinen verursacht werden, wobei die Motoren zu jeder Zeit zufällig an den Mikrotubulus andocken und sich von ihm lösen können.
Die Zukunft des minimalen Systems
Das rekonstruierte System öffnet die Tür zu der Erforschung anderer faszinierender Fragen zum intrazellulären Transport. „Wir sind daran interessiert zu sehen, welchen Einfluss Umweltfaktoren wie Temperatur und Viskosität auf das System haben. Wir planen auch, weitere Variablen in das System einzuführen, z. B. Proteine, die an Mikrotubuli binden, und zu sehen, ob sie - sozusagen als molekulare Straßensperren - einen Typ von Motor mehr als den anderen beeinflussen würden. Wenn ja, könnten sie die Transportrichtung regulieren, beispielsweise in neuronalen Zellen, in denen behinderter und fehlgeleiteter Transport oft zu pathologischen Zuständen führt“, sagt Prof. Diez.
Die kollaborative Studie wurde von der Deutschen Forschungsgemeinschaft (DFG) und dem Bundesministerium für Bildung und Forschung (BMBF) finanziert. Die Arbeit wäre ohne die Unterstützung der Technologieplattform am Center for Molecular and Cellular Bioengineering der TU Dresden und insbesondere der Molecular Imaging and Manipulation Facility unter Leitung von Dr. Jens Ehrig nicht möglich gewesen.
Originale Veröffentlichung
Ashwin I. D’Souza, Rahul Grover, Gina A. Monzon, Ludger Santen & Stefan Diez: Vesicles driven by dynein and kinesin exhibit directional reversals without regulators. Nature Communications (November 2023)
Link: https://doi.org/10.1038/s41467-023-42605-8
