Jul 22, 2022
Good blood circulation does not protect against sudden cell loss
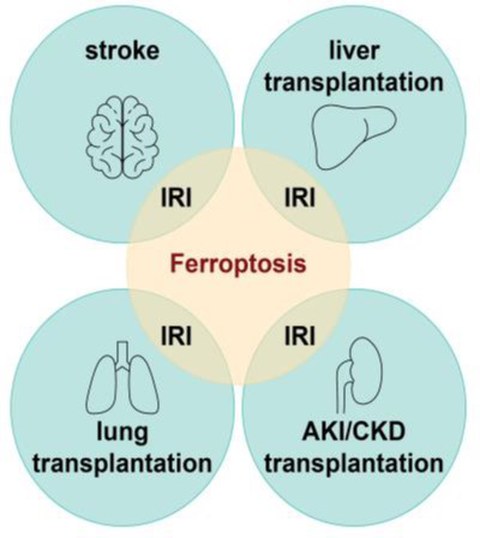
Die Ferroptose, eine Form des regulierten nekrotischen Zelltods, hat sich als ein gemeinsamer Pathomechanismus der IRI herausgestellt.
Good blood circulation does not protect against sudden cell loss
When after an ischemic event reperfusion is induced, which happens for instance during organ transplantation or resuscitation after cardiac arrest, this reperfusion can paradoxically cause additional damage to the affected tissue. Such ischemia-reperfusion injuries (IRI) are a serious complication, responsible for a variety of clinically important conditions including stroke and acute kidney injury.
Ferroptosis, a recently described form of regulated necrotic cell death, has emerged as a common underlying pathomechanism of tissue IRI, and represents a most promising therapeutic target to prevent extensive IRI-driven cell loss, tissue dysfunction and necroinflammation. Ferroptosis is a form of cell death characterized by iron-dependent lipid peroxidation, ultimately leading to plasma membrane rupture and death of the cell. To date, there is no biomarker available that unequivocally allows for the detection of ferroptosis, and despite the development of ferroptosis inhibitors there is no treatment for IRI.
Dr. Maria Fedorova, leader of the research group “Lipid Metabolism: Analysis and Integration” at the Center of Membrane Biochemistry and Lipid Research (ZML) at the Faculty of Medicine of TUD, is the project coordinator of the FERROPath consortium (Ferroptosis as a common underlying pathomechanism in tissue ischemia/reperfusion injury) that will be funded by the Bundesministerium für Bildung und Forschung (BMBF) from July 2022 for 3 years. The consortium brings together six partners with highly complementary expertise in (oxi-)lipidomics, bioinformatics, drug discovery, immunology, organ transplantation, pre-clinical and clinical research in a highly interdisciplinary approach. Specifically, the researchers from Dresden, München, Regensburg and Essen aim to identify and validate common ferroptotic signatures and molecular mechanisms in organs mostly affected by IRI such as brain, liver, lung and kidney. Furthermore, ferroptosis-specific biomarkers are supposed to be identified that are urgently needed for clinical monitoring of disease progression and can be used as markers to assess therapeutic success. Ultimately, the researchers strive to provide proof-of-concept for next generation ferroptosis inhibitors.
Maria Fedorova leads, next to her role as project coordinator of the FERROPath consortium, also the subproject „Identification, confirmation and high-throughput translation of IRI ferroptosis biomarkers” in the area of (oxi-)lipidomics and bioinformatics. Prof. Dr. Andreas Linkermann, nephrologist at the University Hospital Carl Gustav Carus of the TUD, heads the subproject „The role of oxidized phospholipids in non-cell-autonomous ferroptotic cell death propagation and kidney IRI“, in which he and his team aims at contributing models for IRI in the kidney.
Further information regarding the research of FERROPath:
Dr. Maria Fedorova (project coordinator and subproject leader)
AG Lipid Metabolism: Analysis and Integration
Center of Membrane Biochemistry and Lipid Research (ZML) at the Faculty of Medicine Carl Gustav Carus of TU Dresden
Tatzberg 47/49, 01307 Dresden
+49 351 796 36617
www.zml-dresden.de
Prof. Dr. Andreas Linkermann (subproject leader)
Universitätsklinikum Carl Gustav Carus
an der Technischen Universität Dresden
Medizinische Klinik und Poliklinik III
Bereich Nephrologie
Fetscherstraße 74
01307 Dresden
Contact:
Dr. Kathrin Schmeisser (Project Manager FERROPath)
Center of Membrane Biochemistry and Lipid Research (ZML) at the Faculty of Medicine Carl Gustav Carus of TU Dresden
Tatzberg 47/49, 01307 Dresden
Phone: +49 351 796-36638
Fax: +49 351 796-36699
www.zml-dresden.de
kathrin.schmeisser@tu-dresden.de


